题目内容
【题目】为测定某地石灰石中碳酸钙的质量分数,某兴趣小组将一定质量的石灰石样品粉碎后分成两等份,进行如下实验:
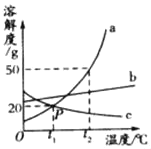
(1)一份放于烧杯中,向烧杯中逐渐加入某一浓度的盐酸,反应过程测得剩余固体质量与加入盐酸的质量关系如图所示(石灰石中的杂质不与盐酸反应,也不溶与水)。请回答下列问题:
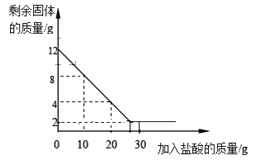
①石灰石样品中碳酸钙的质量分数________;
②通过计算求所用盐酸的溶质质量分数为__________。
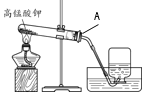
(2)另一份进行如下图所示的实验:把产生的CO2气体用足量的烧碱溶液吸收,同时测量B瓶烧碱溶液增加的质量,结果如下表所示:
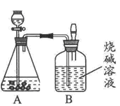
时间/分 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
B增加的质量 | 0 | 2 | 3 | 4 | 4.6 | X | 4.6 |
①右上表中,第5分钟时,x=______________;
②该实验测得样品中碳酸钙的质量分数_________(填大于、小于或等于)另一实验,其原因可能是______________________________。
【答案】 83.3% 29.2% 4.6 大于 盐酸具有挥发性,生成的二氧化碳气体中混有的氯化氢气体被氢氧化钠吸收,测量结果偏高
【解析】本题考查了根据化学方程式的计算。第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
(1)①由图像可知最终反应后固体的固体为2g,是剩余的没有反应的杂质的质量,样品中碳酸钙的质量=12g-2g=10g,石灰石样品中碳酸钙的质量分数=![]() ×100%=83.3%;
×100%=83.3%;
②由图像可知碳酸钙与盐酸反应时,消耗盐酸为10g时,碳酸钙的用量是12g-8g=4g;
设:10g盐酸中所含HCl的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
4g x
![]() x=2.92g
x=2.92g
盐酸中溶质的质量分数=![]() ×100%=29.2%;
×100%=29.2%;
(2)①由表格可知,当二氧化碳质量达到4.6g时质量不再增加,也就是二氧化碳的最大量是4.6g,所以第5分钟时,x=4.6g;
②设:样品中碳酸钙的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.6g
![]() 解得:x=10.45g
解得:x=10.45g
大理石样品中CaCO3的质量分数=![]() ×100%=87.1%;所以该实验测得样品中碳酸钙的质量分数大于另一实验,其原因可能是盐酸具有挥发性,生成的二氧化碳气体中混有的氯化氢气体被氢氧化钠吸收,测量结果偏高。
×100%=87.1%;所以该实验测得样品中碳酸钙的质量分数大于另一实验,其原因可能是盐酸具有挥发性,生成的二氧化碳气体中混有的氯化氢气体被氢氧化钠吸收,测量结果偏高。

 名校课堂系列答案
名校课堂系列答案【题目】请从A或B两题中任选1个作答,若两题均作答,按 A计分。
A用下图装置制取氧气 | B用下图装置制取二氧化碳 |
| |
(1)仪器a的名称是_______。 (2)制氧气的化学方程式为________。 (3)能用排水法收集氧气的原因是_______。 | (1)仪器b的名称是_______。 (2)制二氧化碳的化学方程式为_______。 (3)能用向上排空气法收集二氧化碳的原因是_______。 |