题目内容
【题目】Ⅰ.黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn:7%、ZnO:31%、Cu:50%、CuO:5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
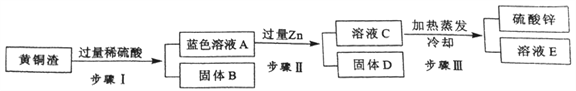
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
(1)步骤Ⅰ中产生气体的化学方程式为___________________。
(2)溶液A中的金属阳离子有__________(填化学式)
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为___,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是____。
(4)溶液A_____(填“大于”、“小于”或“等于”)溶液C的质量。
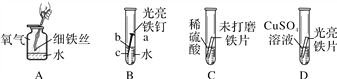
Ⅱ.在探究金属活动性的实验课上,同学们把打磨光亮的铝片插入硫酸铜溶液中,过一会儿,发现了一个“意外现象”:在铝片表面看到有红色固体析出的同时,还看到有少量的气泡冒出,写出生成红色固体的化学方程式___________________.
【提出问题】该气体是什么呢?
【猜想与假设】猜想一:O2 猜想二:H2 猜想三:CO2 猜想四:SO2
同学们经过讨论,一致认为猜想三不成立,理由是_____________________.
【实验验证】
(5)有同学闻了一下该气体,发现无气味,证明猜想四也不成立,理由是___________.
(6)将产生的气体经验纯后,用导管导入到点燃的酒精灯火焰上,气体安静燃烧,产生淡蓝色火焰.
【实验结论】__________________.
【反思与交流】CuSO4溶液可能显_______性(填“酸”或“碱”或“中”).
【答案】 Zn+H2SO4=ZnSO4+H2↑ Zn2+、Cu2+ 过滤 玻璃棒 小于 2Al+3CuSO4=3Cu+Al2(SO4)3 反应物中不含碳元素 二氧化硫有刺激性气味 猜想一不成立,猜想二成立 酸
【解析】Ⅰ. (1)氧化锌和氧化铜分别与稀硫酸反应生成硫酸锌、硫酸铜和水,没有气体产生;而锌与稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;(2)锌与稀硫酸反应生成硫酸锌和氢气,氧化锌与硫酸反应生成硫酸锌和水,氧化铜与硫酸反应生成硫酸铜和水,其中的金属阳离子是锌离子和铜离子;(3)由图可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜;过滤和蒸发操作中均用到玻璃棒这种玻璃仪器;
(4)A到C的过程中发生的反应是:Zn+CuSO4=Cu+ZnSO4,
160 161
由此可见溶液的质量增重了,溶液A小于溶液C的质量;Ⅱ.铝和硫酸铜反应生成硫酸铝和铜,化学方程式为:2Al+3CuSO4=3Cu+Al2(SO4)3;【猜想与假设】化学反应前后,元素种类不变,所以经过讨论,一致认为猜想三不成立,理由是:反应物中不含碳元素;【实验验证】(5)有同学闻了一下该气体,发现无气味,证明猜想四也不成立,理由是:二氧化硫有刺激性气味;氧气有助燃性,氢气有可燃性,所以(6)将产生的气体经验纯后,用导管导入到点燃的酒精灯火焰上,气体安静燃烧,产生淡蓝色火焰。【实验结论】猜想一不成立,猜想二成立;酸会与活泼金属反应生成氢气,所以CuSO4溶液可能显酸性。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案