题目内容
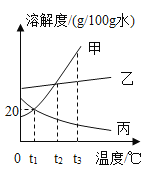
【题目】在某金属铁的样品中可能含有Zn、Mg、Al、Cu等杂质金属中的两种。取5.6g样品跟足量稀硫酸反应,得到0.2g氢气,则此铁的样品中不可能含有的杂质金属组是( )
A. Mg和Cu B. Mg和Zn C. Mg和Al D. Zn和Al
【答案】C
【解析】设5.6g纯铁生成氢气的质量为![]()
Fe+H2SO4═FeSO4+H2↑
56 2
5.6g x
![]() ,x=0.2g
,x=0.2g
5.6g铁的样品能生成0.2g氢气,说明铁中混有的金属,一种与酸反应生成氢气的能力比铁强,一种与酸反应生成氢气的能力比铁弱或不产生氢气A、相同质量的镁生成氢气的质量比铁多,铜不与酸反应生成氢气,铁中可能混有这两种金属;B、相同质量的锌生成氢气的质量比铁少,相同质量的铝生成氢气的质量比铁多,铁中可能混有这两种金属;C、相同质量的镁和铝生成氢气的质量都比铁多,铁中不可能混有这两种金属;D、相同质量的锌生成氢气的质量比铁少,相同质量的镁生成氢气的质量比铁多,铁中可能混有这两种金属。故选C。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。
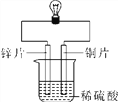
(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能