题目内容
【题目】在“新冠肺炎”的医疗中会使用大量的溶液,而大部分溶液都可分为酸、碱、盐是初中化学学习的重要内容。
(1)盐酸、硫酸等常见的酸都具有相似的化学性质,是因为它们在水溶液中都解离出___________(填离子符号)。
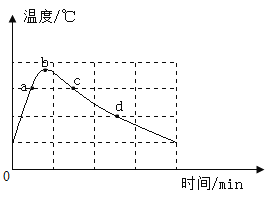
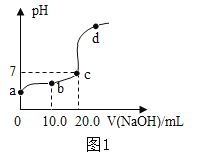
(2)向20.0mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液中的pH随所加氢氧化钠溶液的体积变化如图1所示。下列有关叙述正确的是_________。
A b、d点对应溶液的pH:b>d
B 向b点对应的溶液中滴加石蕊溶液,溶液呈无色
C 所用氢氧化钠溶液的质量分数一定为30%
D d点对应的溶液中溶质是NaCl和NaOH
(3)己知某“84消毒液”瓶体部分标签如图2所示:
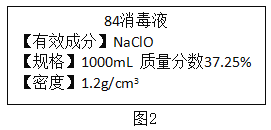
①该瓶“84消毒液”中NaC1O的质量为_________g。
②工业可用氯气和氢氧化钠溶液反应来制取NaClO,同时生成食盐的主要成分和水,写出该反应的化学方程式_____________。
(4)实验室有一瓶长期露置于空气中的氢氧化钠溶液,为确定其成分,小组同学进行了如下探究。
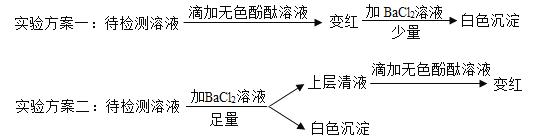
①根据实验方案二确定该瓶溶液的溶质成分是什么_________?
②实验方案一不能准确确定溶质成分,请说明理由_________。
③实验室为防止NaOH溶液变质,可采取什么措施_________?
(5)某造纸厂产生含氢氧化钠的废水需经处理呈中性后再排放。小明取51g该废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,共消耗稀硫酸49g,计算所得溶液溶质质量分数_________。
【答案】H+ D 447 ![]() NaOH和Na2CO3 因为NaOH、Na2CO3均可使无色酚溶液变红,二者之中只有Na2CO3能与BaC12反生成白色沉淀,NaOH不反应,所以不能确定NaOH是否存在。(合理即可) 密封保存 7.1%
NaOH和Na2CO3 因为NaOH、Na2CO3均可使无色酚溶液变红,二者之中只有Na2CO3能与BaC12反生成白色沉淀,NaOH不反应,所以不能确定NaOH是否存在。(合理即可) 密封保存 7.1%
【解析】
(1)盐酸、硫酸属于酸。酸具有相似的化学性质是因为酸在水溶液中能够电离出氢离子。故答案为:H+;
(2)A、由图可知,b点溶液的pH<7,d点溶液的pH>7,所以b、d点对应溶液的pH:b<d。A错误;
B、由图可知,b点所示溶液的pH<7,溶液显酸性,加入紫色石蕊试液变红色。B错误;
C、由化学方程式可知,NaOH+HCl=NaCl+H2O。由于题干中没有提及两种溶液的密度,所以无法确定所需氢氧化钠溶液的溶质质量分数。C错误;
D、d点所示溶液的pH>7,所示溶液的溶质既有酸碱中和生成的氯化钠,还有过量的氢氧化钠。所以溶质是NaCl和NaOH。D正确。
故选D;
(3)①该消毒液的体积为1000mL,密度为1.2g/cm3,则质量为:1000mL×1.2g/cm3=1200g。该溶液的溶质质量分数为37.25%,所以溶质的质量为:1200g×37.25%=447g。故答案为:447;
②食盐的主要成分是氯化钠,氢氧化钠和氯气反应生成氯化钠、NaClO和水。故答案为:![]() ;
;
(4)①根据实验方案二,待检测溶液中先加入足量的BaCl2溶液,碳酸钠和氯化钡完全反应生成碳酸钡沉淀和氯化钠。过滤,向上层清液中滴加无色酚酞,溶液变红,说明溶液中还含有NaOH。所以瓶中溶液的溶质是NaOH和Na2CO3。故答案为:NaOH和Na2CO3;
②因为碳酸钠溶液也呈碱性,也能使无色酚酞变红。所以实验方案一不能准确确定溶质一定含有NaOH。而NaOH和Na2CO3中,只有Na2CO3能与氯化钡溶液反应生成白色沉淀,NaOH不反应。所以无法确定溶质中是否存在NaOH。故答案为:因为NaOH、Na2CO3均可使无色酚溶液变红,二者之中只有Na2CO3能与BaC12反生成白色沉淀,NaOH不反应,所以不能确定NaOH是否存在。(合理即可);
③NaOH溶液易与空气中的二氧化碳反应生成碳酸钠溶液而变质。所以应该密封保存。故答案为:密封保存;
(5)用硫酸中和含氢氧化钠的废水,则硫酸和氢氧化钠反应生成硫酸钠和水。恰好完全反应时,溶质为硫酸钠。
恰好完全反应时,消耗硫酸的质量为:49g×10%=4.9g。
设反应生成的硫酸钠的质量为x。

解得x=7.1g
所以,恰好完全反应是,溶质质量分数为:![]() 。
。

【题目】某同学在学习中构建了“氮及其化合物的价、类关系图”。
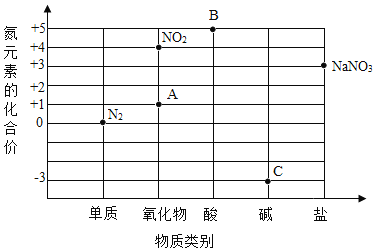
(1)写出图中A、B、C点对应物质的化学式各一个:_____、____、____。
(2)与图中的点对应物质不相符合的化学式是____。
(3)在纯净物中,根据___,可以把它们分成单质和化合物。
(4)氮气是由____(填“分子”“原子”或“离子”)构成的。
(5)完成鉴别硫酸钾和硫酸铵两种固体化肥的实验报告。
实验步骤 | 实验现象 | 实验结论 |
_________________ | ____________________ | ________________________ |