题目内容
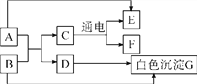
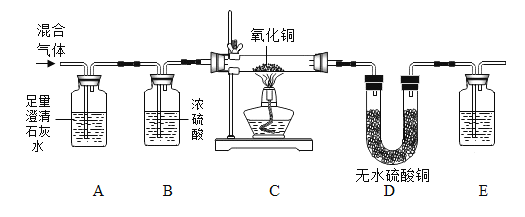
【题目】为了验证混合气体中确实存在CO2、H2和CO,进行如下图所示的实验:
资料:①无水硫酸铜是白色粉末,吸水后变蓝;②浓硫酸可除去气体中水蒸气
(1)A装置的作用是_____;
(2)C装置中的实验现象是_____;
(3)E装置中盛放的试剂是_____;
(4)证明氢气存在的实验现象是_____。
【答案】验证并除去混合气体中的二氧化碳 黑色固体变红 澄清石灰水 D中白色固体变蓝
【解析】
澄清石灰水可验证二氧化碳,氢气和一氧化碳不好直接验证,需要转化成二氧化碳和水分别验证。混合气体先通过足量澄清石灰水,澄清石灰水变浑浊验证了二氧化碳,还能把所有二氧化碳都除去,为后面一氧化碳的验证排除干扰;通过浓硫酸除去从石灰水中带出的水分;氢气、一氧化碳都与氧化铜反应,分别生成铜、水,铜、二氧化碳;D中硫酸铜白色粉末变蓝,证明有水生成,即证明有氢气;后面再通过澄清石灰水,石灰水变浑浊证明有二氧化碳生成,这个二氧化碳就是一氧化碳与氧化铜反应生成的,从而证明原混合气体中有一氧化碳。
(1)由于二氧化碳能与氢氧化钙反应生成了碳酸钙和水,所以A装置的作用是:验证并除去混合气体中的二氧化碳;
(2)由于在加热的条件下一氧化碳与氧化铜反应生成铜、二氧化碳,氢气与氧化铜反应生成铜和水,所以C装置中的实验现象是:黑色固体变红;
(3)由于二氧化碳能与氢氧化钙反应生成了碳酸钙和水,常用澄清的石灰水检验二氧化碳气体,所以E装置中盛放的试剂是:澄清石灰水;
(4)由于氢气还原氧化铜生成了水,水能使无水硫酸铜变成蓝色,所以证明氢气存在的实验现象是:D中白色固体变蓝。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】硝酸钾和氯化钠在不同温度下的溶解度如下表,请回答。
温度/℃ | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |
氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
(1)60℃时硝酸钾的溶解度是_____g。
(2)若硝酸钾中混有少量的氯化钠,提纯硝酸钾可以采取的方法是_____。
(3)20℃时,将硝酸钾和氯化钠两种固体各36g分别加入盛有100水的烧杯中,充分溶解后可观察到如图所示的现象。
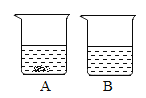
①烧杯A中溶解的物质是_____。
②若向烧杯A中加入一定量的水使剩余固体刚好全部溶解变为饱和溶液,则溶液中溶质的质量分数_____(填“变大”、“变小”或“不变”)。
③若将A、B烧杯中的物质同时升温至80℃,则A、B中溶质的质量_____(填“一定”或“不一定”)相等。