题目内容
【题目】一包白色固体粉末,可能由氯化钠、氢氧化钠、碳酸钠、硫酸钠、氢氧化钙中的一种或几种组成,为了探究这包粉末的组成,化学兴趣小组的小王、小林、小丽同学分别做了以下实验:
(1)小王同学:取样,加入足量的稀盐酸,产生气泡。
(2)小林同学:取样,加入水溶解,无现象
(3)小丽同学为了进一步探究原粉末的成分,取小林同学实验所得的液体,向其中加入无色酚酞溶液变成红色,并进行了如下实验,请回答下列问题
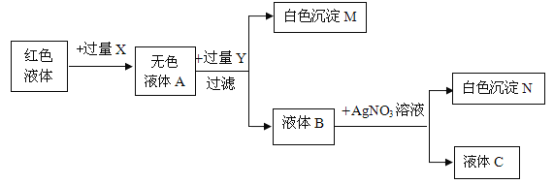
①试剂X为___________ 白色沉淀M的化学式________(填化学式,下同)
②通过上述实验确定该白色粉末中一定含有__________一定不含有_________经过同学讨论确定,有一种物质不能确定它的存在,请设计实验证明它的存在___________
【答案】稀硝酸 BaSO4 Na2CO3 Na2SO4 NaCl Ca(OH)2 取少量红色溶液与于试管中,加入过量的硝酸钡溶液,溶液仍然为红色,证明有氢氧化钠。(其它答案合理即可)
【解析】
(1)小王同学:取样,加入足量的稀盐酸,产生气泡。则白色粉末中一定有碳酸钠,碳酸钠与稀盐反应产生二氧化碳气体;
(2)小林同学:取样,加入水溶解,无现象,则溶液中一定没有氢氧化钙,因为氢氧化钙与碳酸钠反应产生白色沉淀;
(3)小丽同学为了进一步探究原粉末的成分,取小林同学实验所得的液体,向其中加入无色酚酞溶液变成红色(混合溶液显碱性),加入过量稀硝酸、酸化,产生二氧化碳气体,溶液变为无色,再加入过量的稀硫酸,有硫酸钡白色沉淀产生,则原溶液中一定有硫酸钠;过滤后再加入硝酸银溶液,产生氯化银白色沉淀,则原溶液一定有氯化钠;
①试剂X为:稀硝酸; 白色沉淀M是硫酸钡,化学式BaSO4;
②通过上述实验确定该白色粉末中一定含有Na2CO3 Na2SO4 NaCl,一定不含有Ca(OH)2;可能含有:NaOH ;设计实验证明它的存在:取少量红色溶液与于试管中,加入过量的硝酸钡溶液,硝酸钡与碳酸钠反应产生碳酸钡沉淀和水,若溶液仍然为红色,说明混合溶液显碱性,证明有氢氧化钠。

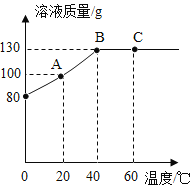
【题目】某兴趣小组的同学发现实验室中有一瓶敞口放置的氢氧化钠固体,他们十分好奇该瓶氢氧化钠是否变质,于是进行了如下实验操作。他们取一定量该氢氧化钠样品,向其中加入一定量水充分溶解得到50 g溶液,再向其中加入一定溶质质量分数的稀盐酸,测得产生气体的质量如下表所示。并对溶液的质量进行测定,绘制了如图所示的曲线。
加入稀盐酸的质量/g | 5 | 10 | 15 | 20 | 25 |
产生二氧化碳的质量/g | 0 | 0 | 0.22 | 0.44 | 0.44 |
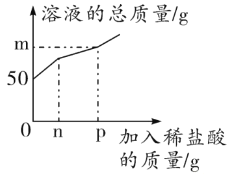
试分析计算:
(1)曲线中m的值为______________________________;n的值为_________________________________。
(2)所用稀盐酸的溶质质量分数_____________。
(3)恰好完全反应时溶液中溶质的质量分数_____________。(计算结果精确到0.1% )