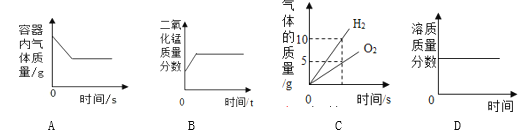
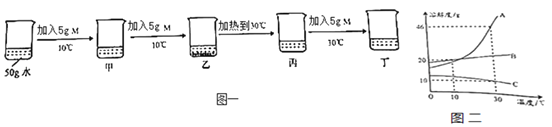
题目内容
【题目】某化学活动兴趣小组用如图装置进行一氧化碳还原氧化铜的探究实验,反应一段时间后,玻璃管内黑色粉末全部变成红色,澄清石灰水变浑浊。
(1)从安全环保的角度考虑,上述装置的不足之处是_____。
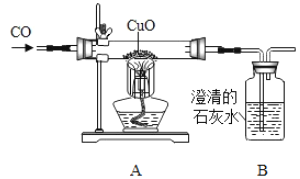
(2)装置A中发生反应的化学方程式为_____。
(3)同学们通过查阅资料得知:氧化亚铜(Cu2O)和铜均为红色固体,且Cu2O能和稀硫酸反应,反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O.他们对反应后玻璃管中的红色固体进行如下探究:
(提出问题)反应后生成的红色固体成分是什么?
(作出猜想)猜想一:红色固体是Cu; 猜想二:红色固体是Cu2O;猜想三:红色固体是_____。
(实验探究)设计如下实验方案
实验操作 | 现象 | 结论 |
取少量红色固体于试管中,加入过量的稀硫酸。 | ______ | 红色固体含有Cu2O |
(思考与分析)甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是_____。
为此,同学们补充进行了以下实验:称取mg红色固体于试管中,加入过量的稀硫酸充分反应,然后过滤、洗涤、干燥、称量,得到ng固体。当n>_____(含m的代数式)时,可以得出猜想三的结论正确。
【答案】没有处理尾气 CuO+CO![]() Cu+CO2 Cu、Cu2O 红色固体部分溶解,溶液由无色变蓝色 红色固体是Cu、Cu2O时,实验现象相同
Cu+CO2 Cu、Cu2O 红色固体部分溶解,溶液由无色变蓝色 红色固体是Cu、Cu2O时,实验现象相同 ![]()
【解析】
(1)从安全环保的角度考虑,上述装置的不足之处是没有处理尾气,一氧化碳扩散到空气中污染环境;
(2)装置A中,加热条件下一氧化碳和氧化铜反应生成铜和二氧化碳,发生反应的化学方程式为:CuO+CO![]() Cu+CO2;
Cu+CO2;
(3)作出猜想:
猜想一:红色固体是Cu; 猜想二:红色固体是Cu2O;猜想三:红色固体是Cu、Cu2O。
实验探究:
取少量红色固体于试管中,加入过量的稀硫酸,红色固体部分溶解,溶液由无色变蓝色,是因为氧化亚铜和稀硫酸反应生成了硫酸铜,实验过程如下所示:
实验操作 | 现象 | 结论 |
取少量红色固体于试管中,加入过量的稀硫酸。 | 红色固体部分溶解,溶液由无色变蓝色 | 红色固体含有Cu2O |
思考与
甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是红色固体是Cu、Cu2O时,实验现象相同;
设:mg红色固体全部是氧化亚铜,和稀硫酸反应生成铜质量为x,
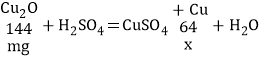
![]()
![]()
如果猜想三的结论正确,则![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
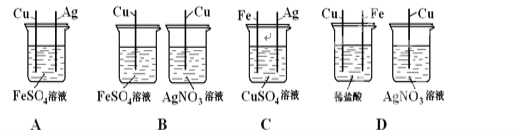
期末冲刺100分创新金卷完全试卷系列答案【题目】同学们在学习碱的化学性质时,进行了如图所示的实验.
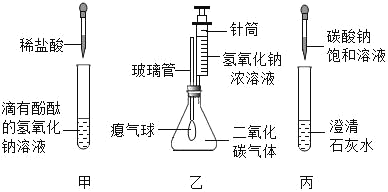
(1)分别写出甲、乙、丙实验中发生反应的化学方程式:
甲_____;乙_____;丙_____.
从微观的角度看,丙反应的实质是_____.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是_____.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
[提出问题]废液中含有哪些物质?
[交流讨论]①一定含有的物质:碳酸钙、指示剂、水和_____(写物质名称).
②还含有能使废液呈碱性的物质.
能使废液呈碱性的物质是什么?同学们有如下猜想.
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是_____(写一种猜想).
[实验设计]小方想用氯化钙溶液来验证小云、小红、小林的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小方的实验设计补充完整.
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液 于试管中,加入过量 氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | _____的猜想正确. |
②_____. | _____的猜想正确. | |
③_____. | _____的猜想正确. |
[反思拓展]在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_____.