题目内容
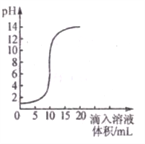
【题目】我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其他杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取11.4g样品放在烧杯中并滴入稀盐酸。当盐酸滴至73g时,烧杯内溶液的总质量为80g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示。(纵坐标表示生成气体质量)试计算
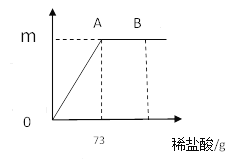
(1)反应到A点时产生的气体质量m=________________________。
(2)求A点时,烧杯内溶液中溶质的质量分数_________。(结果精确到0.1%)
【答案】 m=4.4g 15.6%
【解析】(1)根据质量守恒定律,生成二氧化碳气体的质量=11.4g+73g-80g=4.4g
(2)A点时,碳酸钠与稀盐酸恰好完全反应,设生成氯化钠的质量为x,参加反应的碳酸钠的质量为y
Na2CO3+2HCl ==2NaCl+H2O+CO2↑
106 117 44
y x 4.4g
![]() =
=![]() =
=![]() ,解得x=11.7g,y=10.6g。
,解得x=11.7g,y=10.6g。
原样品中氯化钠的质量为11.4g-10.6g=0.8g
反应后溶液中溶质的质量为0.8g+11.7g=12.5g
反应后溶液中溶质的质量分数为![]() =15.6%
=15.6%
答:m的值为4.4g,A点时,烧杯内溶液中溶质的质量分数为15.6%。

【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应后试管中的溶液出现分层现象:

【实验现象】
时间 | 观察现象 |
3min | 铝条表面有红色固体出现,铝条所在位置及其上方溶液颜色逐渐变浅,下方溶液没有变化 |
0.5h | 铝条表面聚集大量红色物质,铝条周围溶液呈无色透明,下方溶液仍为蓝色,无色溶液和蓝色溶液界面清晰 |
(1)写出铝和硫酸铜溶液反应的化学方程式___________________。
(2)实验前打磨铝条并将其绕成螺旋状的目的分别是_______________、_______________
(3)根据实验现象判断,铜与铝的金属活动性关系为___________________。
(4)根据反应后明显分层的溶液判断,生成的硫酸铝溶液密度_______(填“>”或“=”或“<”)原硫酸铜溶液密度,根据反应前后物质质量的关系分析,导致这种结果的原因可能是_______________。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(5)为促进铝与硫酸铜溶液反应,在配制硫酸铜溶液时加入少量NaCl。
【提出问题】为什么在硫酸铜溶液中加入NaCl,有利于铝与硫酸铜溶液反应?
【提出假设】Cl的存在有利于铝与硫酸铜溶液反应。
【设计实验】请你设计一个合理的实验验证该假设_______________________________。
除以上方案外,你还能想到的另一种方案是_______________________________。