题目内容
【题目】某纯碱产品中含有氯化钠杂质。为测定产品中碳酸钠的质量分数,在20℃时,称取该样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图。求:
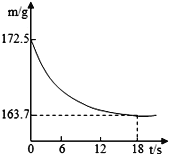
(1)生成CO2的质量__________。
(2)该纯碱样品中Na2CO3的质量分数__________。
(3)完全反应后所得溶液的溶质质量分数___________。(计算结果精确到0.1%)
【答案】 8.8g 80% 17.5%
【解析】(1)根据质量守恒定律,反应前后物质的总质量不变,生成二氧化碳的质量为172.5g-163.7g=8.8g,设碳酸钠的质量为x,氯化钠的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
![]()
x=21.2g y =23.4g
则该纯碱样品中碳酸钠的质量分数为: ![]() ×100%=80%
×100%=80%
(3)完全反应后所得NaCl溶液的溶质质量分数为
![]() ×100%≈17.5%
×100%≈17.5%
答:(1)生成CO2的质量8.8g。
(2)该纯碱样品中Na2CO3的质量分数80%。
(3)完全反应后所得溶液的溶质质量分数17.5%

练习册系列答案
相关题目