题目内容
【题目】某小组同学利用如图所示装置探究铁生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸,B中所盛放的试剂是浓硫酸,作用是除去气体中的水蒸气。(已知铁锈可以溶解在稀盐酸中)
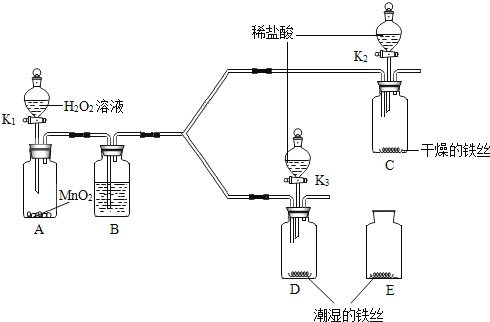
(1)步骤一:关闭![]() 和
和![]() ,打开
,打开![]() ,A中反应的化学方程式是________对比铁丝表面的变化,能够说明铁生锈与水有关的是装置___________(填C、D或E,下同),能够说明铁生锈的快慢与反应物浓度有关的是装置_________。
,A中反应的化学方程式是________对比铁丝表面的变化,能够说明铁生锈与水有关的是装置___________(填C、D或E,下同),能够说明铁生锈的快慢与反应物浓度有关的是装置_________。
(2)步骤二:关闭![]() ,打开
,打开![]() 和
和![]() ,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,广口瓶D中的现象是________。C中反应的化学方程式是__________。
,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,广口瓶D中的现象是________。C中反应的化学方程式是__________。
【答案】2H2O2![]() 2H2O + O2↑ C和D D和E 红棕色固体消失,溶液由无色变成黄色,后来又有气泡冒出
2H2O + O2↑ C和D D和E 红棕色固体消失,溶液由无色变成黄色,后来又有气泡冒出 ![]()
【解析】
(1)过氧化氢在二氧化锰作催化剂的条件下发生分解反应生成水和氧气。做对比实验必须控制变量,C和D中,一个是干燥的铁丝,一个是潮湿的铁丝,其它条件相同。所以能够说明铁生锈与水有关。D和E中,只是氧气的浓度不同,其它条件相同,所以能够说明铁生锈的快慢与反应物浓度有关。
(2)因为广口瓶D中的铁丝生锈了,铁锈主要成分是氧化铁(红棕色),反应的化学方程式为:Fe2O3+6HCl==2FeCl3+3H2O,生成的氯化铁溶液是黄色的,铁丝中的铁能与稀盐酸发生反应,Fe+2HCl=FeCl2+H2↑,所以广口瓶D中的现象是红棕色固体消失,溶液由无色变成黄色,后来又有气泡冒出。C中的铁丝没有生锈,反应的化学方程式是:Fe+2HCl=FeCl2+H2↑。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目