题目内容
【题目】如图是某品牌矿泉水标签的部分说明。
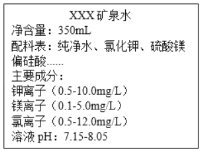
(1)标签主要成分中氯离子的符号为_____。
(2)配料表中硫酸镁的化学式为_____。
(3)一瓶该矿泉水含钾离子的质量最多为_____mg。
(4)偏硅酸(H2SiO3)中硅元素的化合价是_____。
(5)已知溶液的pH<7为酸性溶液,pH=7为中性溶液pH>7为碱性溶液,该品牌矿泉水显_____(填“酸性“中性”或“碱性”)。
(6)生活中的自来水含较多的钙、镁离子,常用_____方法降低水的硬度。
【答案】Cl﹣ MgSO4 3.5mg +4 碱性 煮沸
【解析】
(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,所以氯离子是Cl﹣,故答案为:Cl﹣;
(2)硫酸镁中,镁元素显+2价,硫酸根显﹣2价,故化学式为:MgSO4;故答案为:MgSO4;
(3)根据标签1L水中最多含有钾离子的质量为10.0mg,则一瓶矿泉水中含有钾离子的质量为![]() ,故答案为:
,故答案为:![]() ;
;
(4)根据在化合物中正负化合价代数和为零,偏硅酸中硅元素的化合价为:(+1)×2+x+(﹣2)×3=0,则x=+4;故答案为:+4;
(5)该品牌矿泉水的pH为7.15~8.05,其pH>7,该矿泉水为碱性溶液;故填:碱性;
(6)生活中常用煮沸的方法降低水的硬度。故答案为:煮沸。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究.
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等;猜想2:相等.
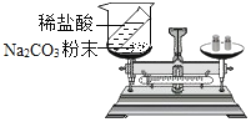
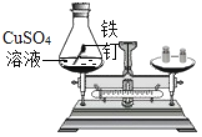
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量.
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生 天平指针向右偏转 | 铁钉表面有红色物质析出,天平指针没有偏转 |
结论 | 猜想1正确 | 猜想2正确 |
(反思评价)经过反复讨论最后得出:在探究化学反应前后各物质的质量总和是否相等时,凡有气体参加或生成的反应,都应在_____中进行.
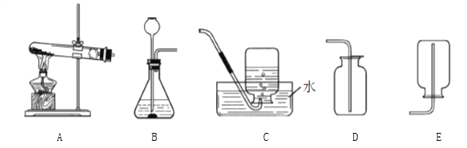
(优化装置)同学们对甲组左盘中的反应装置进行了如图所示的三种改进.经过反复交流,一致认为:A的改进会因_____从而产生误差;B的改进会因反应产生气体使瓶内压强太大,使塞子蹦出而产生危险;C的改进最为科学,那么C的锥形瓶中盛放的NaOH溶液的作用是_____.
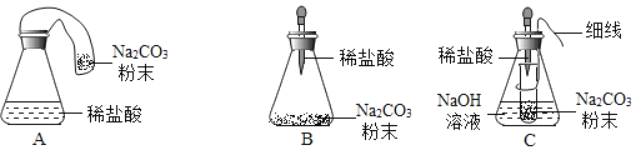
(得出结论)利用C装置进行再次探究,均得出猜想2正确的结论.
进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_____的各物质的质量总和等于反应后生成的各物质的质量总和.
(微观解释)化学反应前后,_____均不变,所以质量守恒.
(应用)某固体物质受热发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_____组成.