题目内容
【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
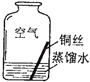
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
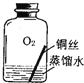
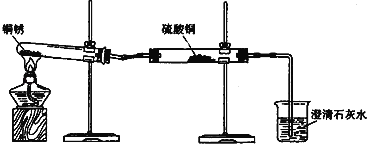
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
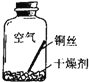
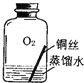
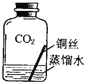
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|
【答案】探究活动一:
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 CO2、H2O、CuO;铜绣由 Cu、C、H、O元素组成;烧杯中发生反应的化学方程式为 CO2+Ca(OH)2═CaCO3↓+H2O. |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
探究活动二:
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 除去蒸馏水中溶解的O2和CO2. (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 按实验4内容重复操作后,再通入一定量的CO2排出部分空气,塞紧胶塞. |
实验2 |
| 在有O2和H2O、无CO2 的环境中,铜不易生锈 | |
实验3 |
| 在有CO2和H2O、无O2的环境中,铜不易生锈 | |
实验4 |
| 铜生锈的条件是 与O2、CO2和H2O同时接触 |
【解析】【进行实验1】硫酸铜粉末变为蓝色,说明有水生成,烧杯中液体变浑浊,说明生成二氧化碳,黑色固体溶解,溶液变为蓝色,说明生成氧化铜,所以加热铜锈生成的物质有氧化铜、水和二氧化碳;铜锈由铜、碳、氢、氧元素组成;烧杯中发生反应的化学方程式为 CO2+Ca(OH)2═CaCO3↓+H2O;
【进行实验2】一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显,说明铜与水、氧气、二氧化碳等物质充分接触时容易生锈,所以可知实验2的结论是:在没有二氧化碳的情况下,铜不易生锈;故填:在没有二氧化碳的情况下,铜不易生锈;
实验3的结论是:在没有氧气的情况下,铜不易生锈;故填:在没有氧气的情况下,铜不易生锈;
实验4的结论是:铜生锈的条件是铜与水、氧气、二氧化碳等物质充分接触;故填:铜与水、氧气、二氧化碳等物质充分接触;
实验反思:(1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是除去水中溶解的氧气;故填:除去水中溶解的氧气;
(2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是在不同浓度二氧化碳中,其它条件相同的情况下完成实验.故填:在含量高的二氧化碳的空气中,将铜丝放入蒸馏水中.

 阅读快车系列答案
阅读快车系列答案【题目】一瓶久置的氢氧化钠固体己经发生了质变,其研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和Na2CO3的混合物;可能全部变质,固体是Na2CO3.
(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是 ;
(2)称取10.6g该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
样品质量 | 反应前总质量 | 反应后总质量 |
10.6g | 148.5g | 146.3g |
请计算:
①产生气体的质量为多少?
②该样品中Na2CO3的质量分数(写出计算过程).
(3)请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量 变质后消耗盐酸的量(填“大于”、“小于”或“等于”).