题目内容
【题目】一瓶久置的氢氧化钠固体己经发生了质变,其研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和Na2CO3的混合物;可能全部变质,固体是Na2CO3.
(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是 ;
(2)称取10.6g该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
样品质量 | 反应前总质量 | 反应后总质量 |
10.6g | 148.5g | 146.3g |
请计算:
①产生气体的质量为多少?
②该样品中Na2CO3的质量分数(写出计算过程).
(3)请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量 变质后消耗盐酸的量(填“大于”、“小于”或“等于”).
【答案】(1)NaOH和Na2CO3的混合物;
(2)①产生气体的质量为2.2g;②该样品中Na2CO3的质量分数为50%;(3)等于.
【解析】(1)加入足量的BaCl2溶液,产生白色沉淀,该白色沉淀是BaCO3,说明该固体成分中含有CO32﹣;再加入CuSO4溶液,产生蓝色絮状沉淀,该蓝色絮状沉淀是Cu(OH)2,说明该固体成分中含有OH﹣;根据题意知,该固体溶液中含有CO32﹣和OH﹣,所以这瓶久置的氢氧化钠固体是NaOH和Na2CO3的混合物.
故填:NaOH和Na2CO3的混合物;
(2)根据质量守恒定律可以知道反应前后减少的质量为生成的二氧化碳的质量,其质量为:148.5g﹣146.3g=2.2g;
设样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
![]()
解得:x=5.3g
该样品中Na2CO3的质量分数为![]() ×100%=50%
×100%=50%
答:该样品中Na2CO3的质量分数为50%;
(3)变质前后钠元素质量不变,所以与盐酸充分反应后生成的氯化钠的质量一定相等,而相等的氯化钠中氯离子的质量相同,所以,变质前后所消耗稀盐酸的质量相等.

【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
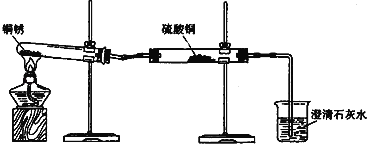
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
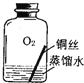
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|