题目内容
【题目】下列说法不正确的是( )
A.镁铝合金mg和足量的盐酸反应生成H20.1g,则m可能是0.8
B.常温下,将5.6g生石灰放入94.4g水中,所得溶液中溶质质量分数小于1%
C.将镁粉和铝粉的混合物7.2g与足量的氧气充分反应,得到的氧化物质量可能为13.6g
D.将铁合金置于氧气中燃烧得到0.44g二氧化碳和29g四氧化三铁,则铁合金是钢
【答案】AC
【解析】
A、设生成0.1g氢气需要镁的质量为x,需要铝的质量为y

x=1.2g
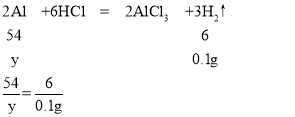
y=0.9g
所以镁铝合金mg和足量的盐酸反应生成H2O.1g,则m在0.9~1.2之间,不可能是0.8,故A不正确;
B、生石灰溶解于水会和水反应:CaO+H2O=Ca(OH)2,Ca(OH)2的溶解度曲线: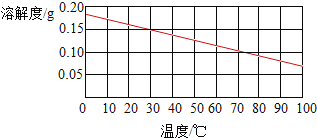
由于Ca(OH)2的溶解度很小,不会超过0.2g,所以质量分数不会大于1%,所以溶液质量分数很小;故B正确;
C、设,7.2g镁与足量氧气反应产生氧化镁的质量为x,7.2g铝与足量氧气反应产生氧化铝的质量为y;
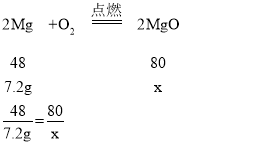
x=12g
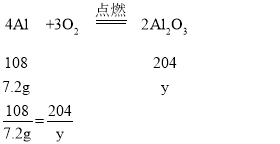
y=13.6g
由此可见,若全部为铝,则得到的氧化物质量13.6g,如果全为镁,得到的氧化物质量12g,由于是混合物,因此混合物得到的氧化物质量应介于12g与13.6g之间,故C不正确;
D、根据质量守恒定律,化学反应前后元素的质量不变,故碳元素的质量为:0.44g×![]() ×100%=0.12g,铁元素的质量为:29g×
×100%=0.12g,铁元素的质量为:29g×![]() ×100%=21g,故合金中碳元素的质量分数为:
×100%=21g,故合金中碳元素的质量分数为:![]() ×100%=0.57%,钢中的含碳量为:0.03%~2%,故属于钢,故D正确。
×100%=0.57%,钢中的含碳量为:0.03%~2%,故属于钢,故D正确。
故选:AC。

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目