题目内容
【题目】试管实验节约药品操作简便现象明显,是课堂教学中研究物质性质与变化的重要方法与手段。下列是初中化学中常见的几组实验:
(1)分别取少量氧化铁粉末和一根生锈铁钉于A、B两支试管中,分别加入等质量的稀盐酸并在酒精灯上微热,观察到两试管中溶液均变黄色,而B试管中还有大量气泡产生。两试管中均发生反应的方程式为_____________,B试管中所得溶液的溶质成分是_____________,一段时间后A试管没有明显变化,B试管中溶液颜色变成浅绿色,这可能是____________之间发生了进一步的反应。
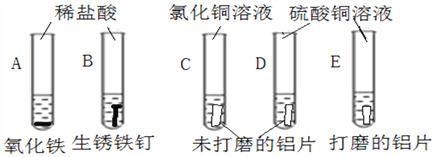
(2)将两片大小、形状相同的未打磨的铝片分别放入C、D两试管中,再分别倒入氯化铜溶液和硫酸铜溶液,结果C试管中产生较多气泡和紫红色固体,D试管中一段时间内无明显现象。将反复打磨了的铝片放入E试管中,加入硫酸铜溶液中产生一些气泡和紫红色固体。对比CD两试管说明_______________会影响铝与铜盐溶液的反应。为了验证这一观点,向D试管中加入下列物质中的_____________,也产生与C试管同样现象。
A.NaCl溶液 B.Na2SO4溶液 C.KCl溶液 D.稀硫酸
对比DE两试管说明________________________会影响了铝与硫酸铜的反应。
(3)向盛有氢氧化钠溶液的G、H两支试管中分别滴入酚酞试液和氯化铁溶液,G中溶液变红色,H中出现_______________________,再分别滴入稀硫酸并充分振荡,G试管中看到____________________________时说明氢氧化钠与稀硫酸恰好完全反应,H试管中则看到____________________,此中和反应有明显现象,请再举一个有明显现象的中和反应实例_________________(用化学方程式表示)。
【答案】 Fe2O3+6HCl==2FeCl3+3H2O 是氯化铁和氯化亚铁(或FeCl3和FeCl2) 铁钉中铁与氯化铁 酸根离子(或阴离子) 铝表面的致密氧化膜 AC 红褐色沉淀 刚刚褪为无色 红褐色沉淀消失,溶液变成黄色 Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓或Cu(OH)2+2HCl=CuCl2+2H2O(合理即可)
【解析】本题考查了酸、碱的性质和实验探究物质变化的条件和影响物质变化的因素。解题时运用控制变量法原理进行分析。。
(1) 两试管中均有氧化铁,氧化铁与盐酸反应生成氯化铁和水。反应的方程式为Fe2O3+6HCl==2FeCl3+3H2O;B试管中发生的反应是氧化铁与盐酸反应生成氯化铁和水,铁与盐酸反应生成氯化亚铁,所得溶液的溶质成分是氯化铁和氯化亚铁(或FeCl3和FeCl2);一段时间后,B试管中溶液颜色变成浅绿色,可能是铁钉中铁与氯化铁进一步反应生成氯化亚铁;
(2) CD两试管所用的铜盐溶液不同,氯化铜与硫酸铜的差别在于所含有的酸根离子(或阴离子)不同,酸根离子(或阴离子)会影响铝与铜盐溶液的反应;根据实验的现象,可以看出含氯离子的反应剧烈;为了验证这一观点,向D试管中加入含有氯离子的物质也产生与C试管同样现象,故选AC;铝表面易形成致密的氧化膜,打磨后氧化膜被除去,对比DE两试管说明铝表面的致密氧化膜会影响了铝与硫酸铜的反应;
(3)氢氧化钠与氯化铁反应生成氢氧化铁的红褐色沉淀和氯化钠,所以H中出现红褐色沉淀;氢氧化钠与硫酸反应生成中性的硫酸钠和水,G试管中看到红色刚刚褪为无色时,说明氢氧化钠与稀硫酸恰好完全反应;氢氧化铁与硫酸反应生成硫酸铁和水,所以H试管中则看到红褐色沉淀消失,溶液变成黄色;有明显现象的中和反应实例可能是:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓(产生沉淀)或Cu(OH)2+2HCl=CuCl2+2H2O(沉淀溶解)。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】葡萄糖能给我们带来甜蜜和健康,它是生产生活中一种常见的有机物,分子式C6H12O6下列有关说法错误的是( )
| A. | 葡萄糖能给人体提供能量,其转化过程为C6H12O6+6O2 |
| B. | 除葡萄糖所属的糖类外,六大营养素还包括蛋白质、油脂、维生素、无机盐和水 |
| C. | 糖类俗称“碳水化合物”,说明葡萄糖就是由C和H2O组成的混合物 |
| D. | 葡萄糖中碳、氢、氧三种元素的质量比为:6:1:8 |