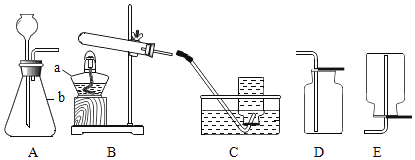
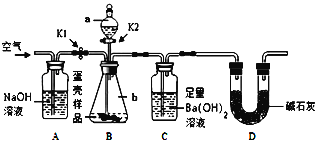
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΡ≥ΤΖ≈ΤΒγΤςΒΡΖœΨ…Βγ¬ΖΑε÷–ΜΙ”–FeΓΔCuΓΔAgΓΔNi(ΡχΘ§“χΑΉ…ΪΫπ τ)Β»Ϋπ τΘ§»γœ¬ΆΦ «Ρ≥≥ΒΦδΜΊ ’CuΓΔAgΓΔNiΒΡΙΛ“’Νς≥ΧΘ§“―÷ΣΘ§2Cu+O2 +2H2SO4![]() 2CuSO4+2H2OΓΘ
2CuSO4+2H2OΓΘ
Θ®1Θ©≤ΌΉςΔΌ÷– Ι”ΟΒΡ≤ΘΝß“«Τς≥ΐ…’±≠ΓΔ≤ΘΝßΑτΆβΘ§ΜΙ–η__________ΘΜ
Θ®2Θ©¬Υ‘ϋΔέ÷–ΜΊ ’ΒΡ÷ς“ΣΫπ τ «__________ΘΜ
Θ®3Θ©ΗυΨί“‘…œΙΛ“’Νς≥ΧΆΦΘ§Ω…“‘ΒΟ≥ωNiΓΔFeΒΡΫπ τΜνΕ·–‘«Ω»θΥ≥–ρ «Ni______FeΘ®ΧνΓΑΘΨΓ±ΜρΓΑΘΦΓ±Θ©ΓΘ
Θ®4Θ©¬Υ“ΚΔέ÷–Φ”»κΉψΝΩΧζΖέΒΡ÷ς“ΣΡΩΒΡ «____________Θ§ΙΧΧεA≥ΐ÷ς“ΣΚ§”–Ά≠ΆβΘ§ΜΙΚ§”–“ΜΕ®ΝΩΒΡΧζΘ§ΈΣΝΥΫχ“Μ≤ΫΧα¥ΩΆ≠Θ§Ω…“‘œρΙΧΧεA÷–Φ”»κ ΝΩΒΡœΓΝρΥαΘ§ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ__________________ΘΜ
Θ®5Θ©¬Υ“ΚΔΌ¥φ‘ΎΒΡΈο÷ ≥ΐΝΥΥ°ΚΆΝρΥαΘ§ΜΙ”–________________Θ®–¥Οϊ≥ΤΘ©ΓΘ
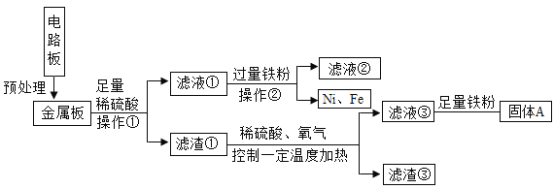
ΓΨ¥πΑΗΓΩ¬©ΕΖ Ag ΘΦ ΫΪΆ≠»Ϊ≤Ω÷ΟΜΜ≥ωά¥ Fe+H2SO4=FeSO4+H2Γϋ ΝρΥα―«ΧζΓΔΝρΥαΡχ
ΓΨΫβΈωΓΩ
Θ®1Θ©Ιΐ¬Υ≤ΌΉςΩ…“‘ΫΪ≤Μ»ή–‘ΙΧΧε¥”»ή“Κ÷–Ζ÷άκ≥ωά¥Θ§Ιΐ¬Υ–η“ΣΒΡ≤ΘΝß“«Τς”–ΘΚ…’±≠ΓΔ¬©ΕΖΓΔ≤ΘΝßΑτΘΜ
Θ®2Θ©Ά≠ΓΔ―θΤχΚΆœΓΝρΥα‘ΎΦ”»»ΒΡΧθΦΰœ¬…ζ≥…ΝρΥαΆ≠ΚΆΥ°Θ§Υυ“‘¬Υ‘ϋΔέ÷–Κ§”–ΒΡΫπ τ «AgΘΜ
Θ®3Θ©Φ”»κΙΐΝΩΒΡΧζΚσΘ§ΒΟΒΫΒΡ¬Υ‘ϋ÷–Κ§”–ΧζΚΆΡχΘ§Υυ“‘Ω…“‘ΒΟ≥ωNiΓΔFeΒΡΫπ τΜνΕ·–‘«Ω»θΥ≥–ρ «NiΘΦFeΘΜ
Θ®4Θ©ΧζΒΡΜνΕ·–‘≈≈‘ΎΆ≠ΒΡ«ΑΟφΘ§¬Υ“ΚΔέ÷–Φ”»κΉψΝΩΧζΖέΒΡ÷ς“ΣΡΩΒΡ «ΘΚΫΪΆ≠»Ϊ≤Ω÷ΟΜΜ≥ωά¥ΘΜΧζΚΆœΓΝρΥαΖ¥”Π…ζ≥…ΝρΥα―«ΧζΚΆ«βΤχΘ§Μ·―ßΖΫ≥Χ ΫΈΣΘΚFe+H2SO4=FeSO4+H2ΓϋΘΜ
Θ®5Θ©¬Υ“ΚΔΌ÷–Θ§ «ΧζΓΔΡχΚΆœΓΝρΥαΖ¥”ΠΘ§Τδ÷–Κ§”–ΒΡ»ή÷ ΈΣΝρΥα―«ΧζΘ§ΝρΥαΡχΘ§ΝρΥαΓΘ

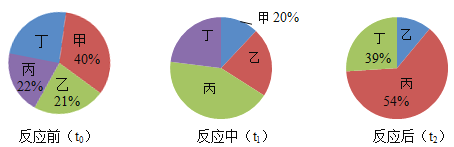
ΓΨΧβΡΩΓΩΧα≥ωΈ ΧβΘΚΒΑΩ«÷–ΒΡ![]() Κ§ΝΩ «Εύ…ΌΡΊΘΩ≥Τ»Γ
Κ§ΝΩ «Εύ…ΌΡΊΘΩ≥Τ»Γ![]() ΒΑΩ«…ηΦΤΝΥ“‘œ¬ΒΡ Β―ιΖΫΑΗ»γΆΦΥυ ΨΒΡ Β―ιΉΑ÷ΟΓΘ
ΒΑΩ«…ηΦΤΝΥ“‘œ¬ΒΡ Β―ιΖΫΑΗ»γΆΦΥυ ΨΒΡ Β―ιΉΑ÷ΟΓΘ
Θ® Β―ι≤Ϋ÷ηΘ©
![]() Α¥»γΆΦΝ§Ϋ”ΚΟΉΑ÷ΟΚσΘ§≤Δ______ΘΜ
Α¥»γΆΦΝ§Ϋ”ΚΟΉΑ÷ΟΚσΘ§≤Δ______ΘΜ
![]() œρBΉΑ÷Ο÷–Φ”»κΒΑΩ«―υΤΖΚσΘ§œ»Ά®»κΩ’Τχ“ΜΜαΕυΘΜ
œρBΉΑ÷Ο÷–Φ”»κΒΑΩ«―υΤΖΚσΘ§œ»Ά®»κΩ’Τχ“ΜΜαΕυΘΜ
![]() Ϋ”œ¬ά¥ΒΡ Β―ι≤ΌΉς «______Θ§÷±ΒΫ______ΈΣ÷Ι
Ϋ”œ¬ά¥ΒΡ Β―ι≤ΌΉς «______Θ§÷±ΒΫ______ΈΣ÷Ι![]() Χν Β―ιœ÷œσ
Χν Β―ιœ÷œσ![]() ΘΜ
ΘΜ
![]() ‘ΌΆ®»κΩ’Τχ“ΜΜαΕυΘ§÷ΝΉΑ÷ΟC÷–≤Μ‘Ό≤ζ…ζ≥ΝΒμΈΣ÷ΙΘΜ
‘ΌΆ®»κΩ’Τχ“ΜΜαΕυΘ§÷ΝΉΑ÷ΟC÷–≤Μ‘Ό≤ζ…ζ≥ΝΒμΈΣ÷ΙΘΜ
![]() ΫΪΉΑ÷ΟC÷–ΒΡΙΧ“ΚΜλΚœΈοΙΐ¬ΥΓΔœ¥Β”ΓΔΚφΗ…Κσ≥ΤΝΩΤδ÷ ΝΩΘΜ
ΫΪΉΑ÷ΟC÷–ΒΡΙΧ“ΚΜλΚœΈοΙΐ¬ΥΓΔœ¥Β”ΓΔΚφΗ…Κσ≥ΤΝΩΤδ÷ ΝΩΘΜ![]() ÷ΊΗ¥…œ ω Β―ιΓΘ
÷ΊΗ¥…œ ω Β―ιΓΘ
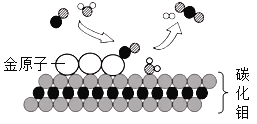
Θ® Β―ι ΐΨίΘ©÷ΊΗ¥ Β―ιΘ§3¥Έ ΐΨίΦ«¬Φ»γœ¬ΘΚ
Β―ι¥Έ ΐ | Β―ι1 | Β―ι2 | Β―ι3 |
ΉΑ÷ΟC÷–≥ΝΒμ÷ ΝΩ |
|
|
|
Θ® Β―ιΖ÷ΈωΦΑ ΐΨί¥ΠάμΘ©
![]() …œ ω ΐΨίΡήΖώ”ΟΆ–≈ΧΧλΤΫ≥ΤΝΩ______ΓΘ
…œ ω ΐΨίΡήΖώ”ΟΆ–≈ΧΧλΤΫ≥ΤΝΩ______ΓΘ![]() ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±
ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±![]()
![]() »τΈόAΉΑ÷ΟΘ§÷±Ϋ”Ά®»κΩ’ΤχΘ§‘ρ≤βΕ®ΫαΙϊΫΪ______ΓΘ
»τΈόAΉΑ÷ΟΘ§÷±Ϋ”Ά®»κΩ’ΤχΘ§‘ρ≤βΕ®ΫαΙϊΫΪ______ΓΘ![]() ΧνΓΑΤΪ¥σΓ±ΓΔΓΑΤΪ–ΓΓ±ΜρΓΑ≤Μ±δΓ±
ΧνΓΑΤΪ¥σΓ±ΓΔΓΑΤΪ–ΓΓ±ΜρΓΑ≤Μ±δΓ±![]() ΉΑ÷ΟΒΡΉς”Ο «______ΓΘ
ΉΑ÷ΟΒΡΉς”Ο «______ΓΘ
![]() Β―ι÷ΊΗ¥3¥ΈΒΡΡΩΒΡ «______ΓΘ
Β―ι÷ΊΗ¥3¥ΈΒΡΡΩΒΡ «______ΓΘ
![]() «κάϊ”Ο3¥Έ Β―ι ΐΨίΒΡΤΫΨυ÷ΒΘ§ΦΤΥψΗΟΒΑΩ«÷–ΒΡ
«κάϊ”Ο3¥Έ Β―ι ΐΨίΒΡΤΫΨυ÷ΒΘ§ΦΤΥψΗΟΒΑΩ«÷–ΒΡ![]() ÷ ΝΩΖ÷ ΐ «______ΓΘ
÷ ΝΩΖ÷ ΐ «______ΓΘ![]() –¥≥ωΦΤΥψΙΐ≥Χ
–¥≥ωΦΤΥψΙΐ≥Χ![]()
ΓΨΧβΡΩΓΩΙιΡ… «―ßœΑΜ·―ßΒΡΜυ±ΨΖΫΖ®ΓΘœ¬Οφ «–ΓΟς’ϊάμΒΡ≤ΩΖ÷Μ·―ß÷Σ Ε,Τδ÷–ΕΦ’ΐ»ΖΒΡ“ΜΉι «
A–‘÷ ”κ”ΟΆΨΨΏ”–Ε‘”ΠΙΊœΒ | BΦχ±π |
ΔΌΧζΖέΩ…Ά§ ±”κ―θΤχΓΔΥ°Ζ¥”Π,Ω…ΉωΥΪΈϋΦΝ ΔΎ“Μ―θΜ·ΧΦΨΏ”–Ω…»Φ–‘,Ω…”Ο”ΎΧζΒΡ“±ΝΕ | ΔΌ”ΟΉœ…Ϊ ·»ο»ή“Κ«χΖ÷COΚΆ ΔΎ»Φ…’≤ΔΦλ―ι≤ζΈο«χΖ÷ |
C≥ΐ»Ξ‘”÷ | D¥Πάμ ¬Ι |
ΔΌ”ΟΉΤ»»ΒΡΆ≠Άχ≥ΐ»ΞΒΣΤχ÷–ΒΡ…ΌΝΩ―θΤχ‘”÷ ΔΎ”Ο»Φ…’Ζ®≥ΐ»ΞΕΰ―θΜ·ΧΦ÷–ΒΡ…ΌΝΩ“Μ―θΜ·ΧΦ‘”÷ | ΔΌΦ“”ΟΒγΤςΉ≈Μπ,”ΟΥ°ΤΥΟπ ΔΎ≥χΖΩΧλ»ΜΤχΙήΒάΉ≈Μπ,ΝΔΦ¥ΙΊ±’ΤχΖß≤Δ«α«αΩΣ¥ΑΆ®Ζγ |
A.AB.BC.CD.D