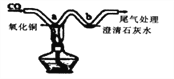
题目内容
【题目】下列图示的实验操作正确的是:
A.  倾倒液体 B.
倾倒液体 B.  测定溶液
测定溶液
C.  称取7.56gNaOH D.
称取7.56gNaOH D. 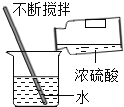 稀释浓硫酸
稀释浓硫酸
【答案】D
【解析】A、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧挨、瓶塞没有倒放、标签没有向着手心,错误;B、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,错误;C、托盘天平的使用要遵循“左物右码”的原则,氢氧化钠具有腐蚀性,应放在玻璃器皿中称量,错误;D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,正确。故选D。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。

(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。
【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:

(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的验方案为:取少量固体混合物________。
(6)从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)______________。
【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
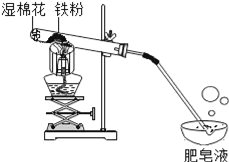
(1)试管尾部放一团湿棉花的目的是____________.
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是____________.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是__.
【实验探究】
实验操作 | 实验现象及结论 |
______________ | ________________ |
【实验结论】铁和水蒸气反应的化学方程式为__.
【反思与交流】该黑色固体不可能是Fe2O3,理由是__.