题目内容
【题目】某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
(1)哪几项反应中盐酸有剩余_______;
(2)m=______g;
(3)试计算这种石灰石矿中碳酸钙的质量分数_________.
【答案】1、2 4.4 70%
【解析】
(1)取稀盐酸200g,平均分成4份进行实验,每次实验使用稀盐酸50g;根据实验结果数据表,5g石灰石完全反应可以生成二氧化碳1.54g,若15g石灰石完全反应生成二氧化碳质量=1.54g×3=4.62,而实验中仅放出4.4g二氧化碳,说明第三次加入样品时石灰石没有完全反应,没有完全反应是由于稀盐酸不足;而第3次实验中加入样品后生成的二氧化碳质量增加,所以可以判断前两次实验中盐酸有剩余;
(2)根据(1)中的分析可以知道,第3次中盐酸量不足,所以第4次加入的样品不能再反应,生成的气体仍为4.4g,即m=4.4;
(3设这种石灰石矿中碳酸钙的质量分数为x。

![]() =
=![]()
解得:x=3.5g
所以石灰石中碳酸钙的质量分数为:![]() ×100%=70%
×100%=70%
答:石灰石中碳酸钙的质量分数为70%。

【题目】为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验装置,实验步骤如下:先分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量。按图示连接好仪器,点燃蜡烛,同时从a导管口抽气,一段时间后熄灭蜡烛,再分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量,实验数据如下表所示:(浓硫酸有吸水性,氢氧化钠和氧化钙既可吸水,又可吸收二氧化碳)
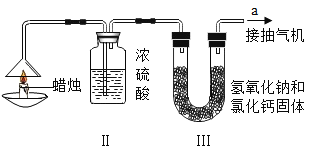
蜡烛 | 装置Ⅱ | 装置Ⅲ | |
反应前的质量/g | 15.8 | 182.3 | 212.2 |
反应后的质量/g | 14.4 | 184.1 | 216.6 |
(1)该实验中测得水的质量为_______g,二氧化碳的质量为_______g。
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为_______。
(3)装置Ⅱ和装置Ⅲ的顺序能否颠倒?_______(填“能”或“不能”)。
(4)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛减小的质量,其原因是_______。
(5)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?____(填“能”或“不能”),理由是____。