题目内容
【题目】某化学小组同学从微观角度进一步理解复分解反应的实质.
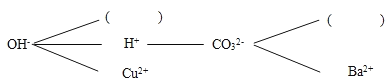
(1)复分解反应的实质是某些阴、阳离子结合生成沉淀、气体或____的过程.
(2)根据复分解反应的实质,形成一个复分解反应网络图(如图所示,图中直线相连的阴、阳离子之间能够两两结合发生反应),请选择合适的离子填入如图括号内(________)、(________),使其两两结合时,一个有气体产生,一个有沉淀(注:沉淀与珍珠粉的成分相同)生成,其中有气体生成的化学反应方程式可能是_______________.
【答案】水 NH4+ Ca2+ NaOH+NH4Cl═NaCl+NH3↑+H2O
【解析】
(1)根据复分解反应发生的条件可以知道,两种物质反应时必须有水、气体或是沉淀生成,否则复分解反应就不能发生;
(2)珍珠粉的主要成分为碳酸钙,所以应该选择钙离子和碳酸根离子结合生成沉淀,而能够和氢氧根离子生成气体为铵根离子,氢氧化钠和铵盐,例如和氯化铵反应,能够生成氨气、水和氯化钠,该反应的化学方程式为:NaOH+NH4Cl═NaCl+NH3↑+H2O

 阅读快车系列答案
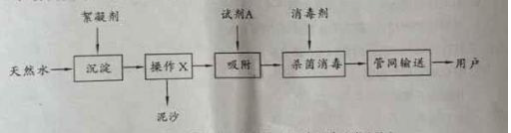
阅读快车系列答案【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
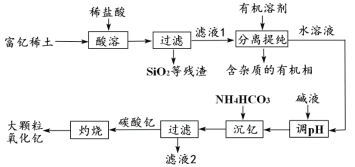
(1)氧化钇(Y2O3)中,Y元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______________________________。
(3)“分离提纯”是为了除去滤液1中的_____________________________(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_______________________________________。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度Kg/L | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是____________(填实验编号)。
【题目】某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
(1)哪几项反应中盐酸有剩余_______;
(2)m=______g;
(3)试计算这种石灰石矿中碳酸钙的质量分数_________.
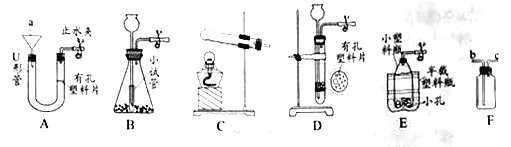
【题目】如图所示装置可用于实验室制取某些气体,并能随开随用。下表中所选用的药品及制取的气体完全正确的一组是( )
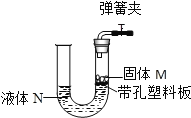
选项 | 选用药品 | 制取的气体 | |
固体M | 液体N | ||
A | 锌粒 | 稀硫酸 | 氢气 |
B | 碳酸钠 | 浓盐酸 | 二氧化碳 |
C | 大理石 | 稀盐酸 | 二氧化碳 |
D | 二氧化锰 | 过氧化氢 | 氧气 |
A.AB.BC.CD.D