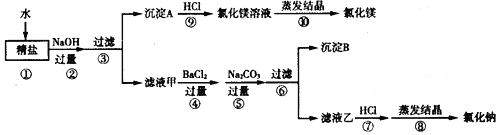
题目内容
【题目】某学习小组的同学欲探究某固体混合物A的成分,已知A中可能含有NH4Cl、MgCl2、Na2CO3、Ba(NO3)2四种物质中的两种或多种.按下图所示进行探究实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应).
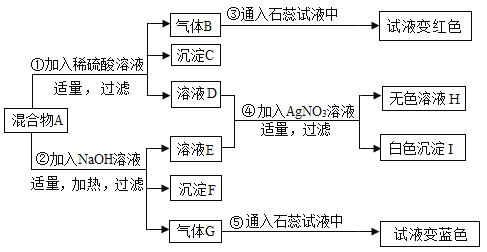
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)写出沉淀C的化学式______。
(2)在常温下,气体G的气味_____。
(3)无色溶液H中肯定存在的酸根离子是______。
(4)写出步骤④中一个生成沉淀I的化学方程式:______。
【答案】BaSO4 有刺激性 硝酸根离子 ![]()
【解析】
题中所给的各种物质“NH4Cl、MgCl2、Na2CO3、Ba(NO3)2”都溶于水,铵态氮肥和碱混合会生成氨气,氨气的水溶液显碱性,氨水能使酚酞变红色;氯离子和银离子会生成白色的氯化银沉淀;硫酸根离子和钡离子会生成白色的硫酸钡沉淀;而二氧化碳通入石蕊溶液中,溶液变红色;再根据硫酸钡沉淀、氯化银沉淀不溶于酸.在混合物A中加入氢氧化钠溶液,得到气体G和溶液E,气体G能使紫色石蕊显蓝色,所以G是氨气,所以混合物A中一定含有氯化铵,氯化铵和氢氧化钠反应生成氨气,氨气溶于水形成氨水,氨水显碱性,所以沉淀C中含有硫酸钡;混合物A中加入稀硫酸,得到溶液D和沉淀C,所以混合物A中含有硝酸钡;与氢氧化钠溶液反应生成沉淀的为氯化镁,沉淀为氢氧化镁沉淀;硝酸钡和硫酸反应会生成白色的硫酸钡沉淀和和硝酸,氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠.
(1)通过分析可知,沉淀C的化学式是:BaSO4;
(2)在常温下,气体G为氨气,其气味有刺激性;
(3)无色溶液H中肯定存在的酸根离子是硝酸根离子;
(4)通过推导可知,溶液D、E中含有氯化钠,故步骤④中一个生成沉淀I,即氯化钠和硝酸银反应会生成氯化银沉淀和硝酸钠,化学方程式为:NaCl+AgNO3═NaNO3+AgCl↓.
故答案为:(1)BaSO4;
(2)有刺激性;
(3)硝酸根离子;
(4)NaCl+AgNO3═NaNO3+AgCl↓.

【题目】某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
(1)哪几项反应中盐酸有剩余_______;
(2)m=______g;
(3)试计算这种石灰石矿中碳酸钙的质量分数_________.
【题目】宏观和微观相结合是认识物质结构的有效方法之一。
(1)已知:X、Y、Z、W四种粒子的核电荷数及核外各电子层电子排布情况如表所示。
X | Y | Z | W | ||
对应元素名称 | 氧 | 镁 | 铝 | 氯 | |
核电荷数 | 8 | 12 | 13 | 17 | |
电子层 | 第一层 | 2 | 2 | 2 | 2 |
第二层 | a | 8 | 8 | 8 | |
第三层 | 3 | 8 | |||
请回答下列问题:
①若X表示原子,a=_______。单质X2与单质Z的反应中,X原子_______(填“得到”或“失去”)电子。
②Y、W形成的化合物化学式为_______(用元素符号表示)。
(2)将稀硫酸与烧杯中Fe、Cu两种金属相混合,微观变化情况如图所示。
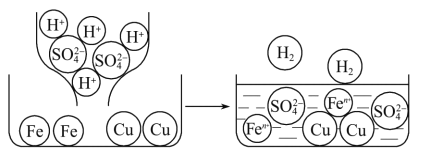
未参加反应的金属:_______,烧杯中发生反应的化学方程式:_______。