题目内容
【题目】水是人类宝贵的自然资源。
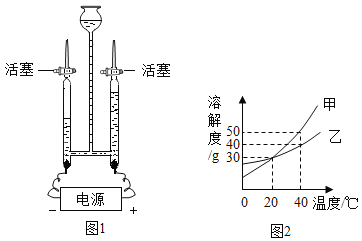
(1)天然水中含有许多杂质,实验室用过滤装置除去水中不溶性杂质,需要用到的仪器有带铁圈的铁架台、烧杯、漏斗和_____(填玻璃仪器)。
(2)生活中常用_____来区分硬水和软水。
(3)氯气可用作自来水的消毒剂,实验室制取氯气的化学方程式为:MnO2+4HCl(浓)![]() X+Cl2↑+2H2O,X的化学式为_____。
X+Cl2↑+2H2O,X的化学式为_____。
(4)天然降水中会溶解部分空气里的_____气体,因此正常雨水的pH≈5.6。
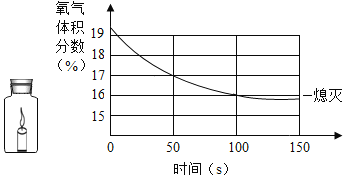
(5)甲和乙两种固体物质的溶解度曲线如图所示。
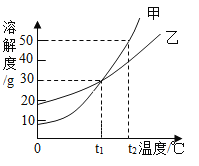
①t1℃时,甲和乙的溶解度_____(填“相等”或“不相等”)。
②t2℃时,若甲和乙的饱和溶液各100g,则两种溶液中溶剂的质量大小关系为:甲_____乙(填“>”、“=”或“<”)。
③t2℃时,150g甲的饱和溶液中溶质的质量分数为_____(计算结果精确到0.1%)。
【答案】玻璃棒 肥皂水 MnCl2 CO2 相等 < 33.3%
【解析】
(1)过滤装置,需要用到的仪器有铁架台、烧杯、漏斗和玻璃棒,故填:玻璃棒。
(2)生活中常用肥皂水区分硬水和软水,故填:肥皂水。
(3)化学方程式:MnO2+4HCl(浓)![]() X+Cl2↑+2H2O,反应前1Mn、2O、4H、4Cl反应后有2Cl、4H、2O和X,根据质量守恒反应前后原子的种类数目不变,故X含有1Mn、2Cl,化学式为MnCl2,故填:MnCl2。
X+Cl2↑+2H2O,反应前1Mn、2O、4H、4Cl反应后有2Cl、4H、2O和X,根据质量守恒反应前后原子的种类数目不变,故X含有1Mn、2Cl,化学式为MnCl2,故填:MnCl2。
(4)天然降水中会溶解部分空气里的CO2气体,生成碳酸,碳酸显酸性,因此正常雨水的pH≈5.6,故填:CO2。
(5)①由图可知t1℃时,甲和乙的溶解度相等,故填:相等。
②t2℃时,甲溶解度大于乙溶解度,故饱和溶液溶质质量分数甲大于乙,相同质量饱和溶液,甲溶质质量大于乙溶质质量,甲溶剂质量小于乙溶剂质量,故填:<。
③t2℃时,150g甲的饱和溶液中溶质的质量分数;![]() ,故填:33.3%。
,故填:33.3%。

【题目】为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
(查阅资料)
Ⅰ.20℃时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
Ⅱ.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
(实验探究)
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_________________________________,实验中,小雨采用两只矿泉水瓶做对比实验的目的是_________________________________。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_____________________________,实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____________________________________。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是___________________________________。
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。
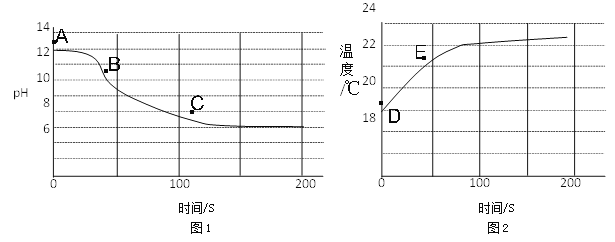
图1中,BC段发生反应的化学方程式为____________________________________。
图2中,DE段温度变化的原因是__________________________________________。
(反思感悟)
(5)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及___________转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。