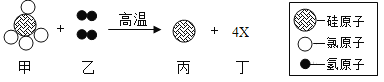
题目内容
【题目】向硫酸铜、硫酸亚铁、硫酸镁的混合溶液中加入一定量的锌粒,充分反应后过滤,滤液呈浅绿色,下列判断正确的是( )
A.滤液中有可能只含两种溶质
B.若与原溶液相比,滤液的质量不一定增大
C.若滤渣只有一种金属,则滤液中金属离子可能不止三种
D.若滤渣中只有两种金属,则滤液中溶质一定有三种
【答案】C
【解析】
由于镁、铁、锌、铜、的金属活动性顺序是:镁>锌>铁>铜,把一定量的锌放到硫酸铜、硫酸亚铁、硫酸镁的混合溶液中,锌首先和硫酸铜反应,再和硫酸亚铁反应,而不能与硫酸镁反应,充分反应后过滤,滤液呈浅绿色,说明硫酸亚铁没有全部参与反应,即滤渣中不可能有锌,一定有最不活泼的金属铜,可能有铁,滤液中一定有硫酸镁、硫酸锌、硫酸亚铁,可能有硫酸铜。
A、由分析可知,滤液中一定有硫酸镁、硫酸锌、硫酸亚铁,可能有硫酸铜,A错。
B、锌和硫酸铜反应: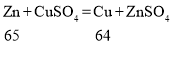 锌和硫酸亚铁反应;
锌和硫酸亚铁反应;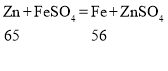 由化学方程式可知,锌与硫酸铜、硫酸亚铁的反应都会使溶液的质量增大,故B错。
由化学方程式可知,锌与硫酸铜、硫酸亚铁的反应都会使溶液的质量增大,故B错。
C、若滤渣中只有一种金属,则一定为最不活泼金属铜,滤液中一定有硫酸镁、硫酸锌、硫酸亚铁,可能含有硫酸铜,金属离子可能不止三种,正确。
D、若滤渣中只有两种金属,则一定为铜和铁,滤液里面一定没有硫酸铜,因为硫酸铜和铁反应,一定有硫酸镁、硫酸锌,可能含有硫酸亚铁,金属离子可能三种,也可能是两种,D错。
故选:C。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
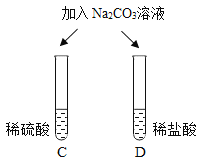
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
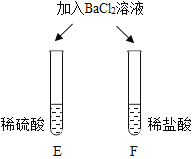
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。
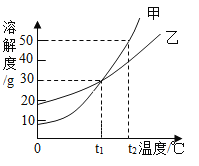
【题目】下列各选项与如图所示曲线相符的是
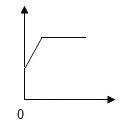
选项 | 实验操作 | 横坐标 | 纵坐标 |
A | 向一定质量的锌粉中加入稀硫酸 | 加入稀硫酸的质量/g | 生成氢气的质量/g |
B | 向一定质量的硝酸银溶液中加入铜粉 | 加入铜粉的质量/g | 溶液的质量/g |
C | 向一定质量的稀盐酸中不断加入碳酸钙粉末 | 加入碳酸钙的质量/g | 溶液的质量/g |
D | 向氯化钠饱和溶液中加入水 | 加入水的质量/g | 溶质的质量/g |
A.AB.BC.CD.D