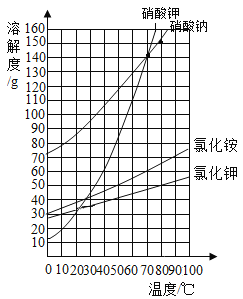
题目内容
【题目】下列化学用语书写正确的是
A. 三个二氧化硫分子:2SO3 B. 两个氮分子:2N
C. HClO中氯元素的化合价:![]() D. 一个铝离子:Al+3
D. 一个铝离子:Al+3
【答案】C
【解析】A、分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,三个二氧化硫分子可表示为:3SO2,错误;B、分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以两个氮分子可表示为:2N2,错误;C、元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以HClO中氯元素的化合价,故可表示为:![]() ,正确;D、离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。故一个铝离子可表示为:Al3+,错误。故选C。
,正确;D、离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。故一个铝离子可表示为:Al3+,错误。故选C。

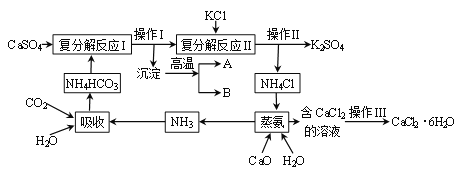
【题目】通过对化学学习,相信你已经初步掌握了实验室制取气体的有关知识.请结合图示回答: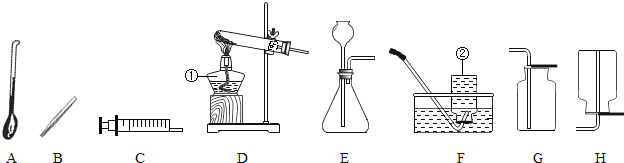
(1)写出图中标示的仪器名称:①___;②___
(2)甲KMnO4制取O2,应选用的发生装置为___(填字母序号,下同),收集装置可选用___(写一种即可);取用KMnO4为___色;写出该反应的化学方程式___.
(3)若用G装置收集氧气,检验氧气是否集满的方法是_____________________
(4)若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,可选用___代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,可用___ (填实验操作名称)的方法分离出二氧化锰。该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和___,其中玻璃棒的作用是___.
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有___.
(6)化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
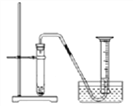
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为___.
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末___(选填“有”、“无”)催化作用,三者中___催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果___.
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___.
记录时间t3,且t1
更正结论为:当___时,反应物浓度越大,反应速率越快。
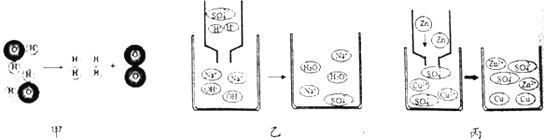
【题目】对稀硫酸的化学性质进行如下研究。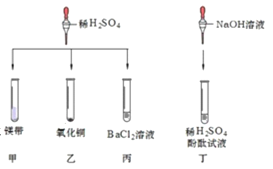
请回答下列问题:
①甲中观察到的现象是_____ ,反应的化学方程式为_________ ; 乙中反应的现象是 __________;
丙中反应的化学方程式为_____;丁中溶液由无色变成红色。
②当甲、乙试管内的固体完全溶解后,将两试管内的物质混合并加入过量的锌片、过滤,则滤渣的成分 是_________,滤液中溶质的化学式为___________。
③请设计能说明 NaOH 与H2SO4是否恰好中和的实验方案。(本题中所用过的试剂不能再用)
_______ | 实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | _________ |
④实验结束后,将乙(其中固体全部溶解)、丁两个实验的废液倒入同一个干净的废液缸中,静置,最终看到上层清液呈红色,废液下层有沉淀。由此推断上层清液的成分有酚酞、水和_____。 写出生成下层沉淀物的化学方程式_____________。
通过上述实验可知,进行化学实验研究,除需要考虑生成什么物质外,还需要考虑_______。