题目内容
【题目】对稀硫酸的化学性质进行如下研究。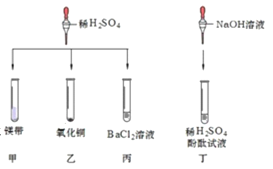
请回答下列问题:
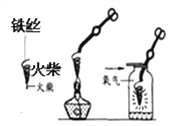
①甲中观察到的现象是_____ ,反应的化学方程式为_________ ; 乙中反应的现象是 __________;
丙中反应的化学方程式为_____;丁中溶液由无色变成红色。
②当甲、乙试管内的固体完全溶解后,将两试管内的物质混合并加入过量的锌片、过滤,则滤渣的成分 是_________,滤液中溶质的化学式为___________。
③请设计能说明 NaOH 与H2SO4是否恰好中和的实验方案。(本题中所用过的试剂不能再用)
_______ | 实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | _________ |
④实验结束后,将乙(其中固体全部溶解)、丁两个实验的废液倒入同一个干净的废液缸中,静置,最终看到上层清液呈红色,废液下层有沉淀。由此推断上层清液的成分有酚酞、水和_____。 写出生成下层沉淀物的化学方程式_____________。
通过上述实验可知,进行化学实验研究,除需要考虑生成什么物质外,还需要考虑_______。
【答案】 镁带逐渐减小,冒气泡 Mg+H2SO4 =MgSO4 +H2↑ 黑色固体逐渐消失,溶液呈蓝色 BaCl2 +H2SO4 =BaSO4 ↓+2HCl Zn,Cu MgSO4,ZnSO4 酚酞 逐渐滴加氢氧化钠溶液,并不断震荡 溶液稍微变红 恰好中和 氯化钡 BaCl2 +Na2SO4=BaSO4+2NaCl 反应物是否过量
【解析】根据所学知识和题中信息知,①甲中观察到的现象是镁带逐渐减小,冒气泡,反应的化学方程式为Mg+H2SO4 =MgSO4 +H2↑;乙中反应的现象是黑色固体逐渐消失,溶液呈蓝色,氧化铜呈黑色,与硫酸反应生成硫酸铜,硫酸铜溶液呈蓝色;丙中反应的化学方程式为BaCl2 +H2SO4 =BaSO4 ↓+2HCl;丁中溶液由无色变成红色,酚酞试液遇碱变红。②当甲、乙试管内的固体完全溶解后,将两试管内的物质混合并加入过量的锌片、过滤,则滤渣的成分是Zn,Cu,锌片过量,锌片与硫酸铜反应置换出铜,锌比铜活泼,滤液中溶质的化学式为MgSO4,ZnSO4。③设计说明 NaOH 与 H2SO4 是否恰好中和。
酚酞 | 实验步骤 | 实验现象 | 实验结论 |
逐渐滴加氢氧化钠溶液,并不断震荡 | 溶液稍微变红 | 恰好中和,酚酞遇酸变红。 |
④实验结束后,将乙(其中固体全部溶解)、丁两个实验的废液倒入同一个干净的废液缸中,静置,最终看到上层清液呈红色,废液下层有沉淀。由此推断上层清液的成分有酚酞、水和氯化钡。生成下层沉淀物的化学方程式是BaCl2 +Na2SO4=BaSO4+2NaCl。进行化学实验研究,除需要考虑生成什么物质外,还需要考虑反应物是否过量。
点睛∶进行化学实验研究时,不仅要考虑反应物和生成物,反应条件,还要考虑到反应物是否过量等因素。酚酞试液遇酸不变色,与碱变红。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案