题目内容
【题目】通过对化学学习,相信你已经初步掌握了实验室制取气体的有关知识.请结合图示回答: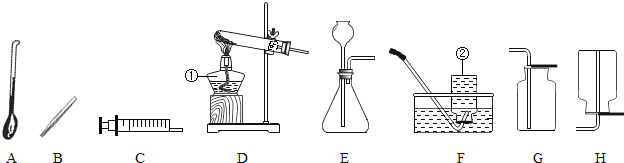
(1)写出图中标示的仪器名称:①___;②___
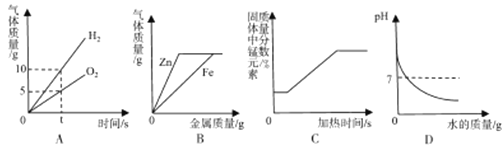
(2)甲KMnO4制取O2,应选用的发生装置为___(填字母序号,下同),收集装置可选用___(写一种即可);取用KMnO4为___色;写出该反应的化学方程式___.
(3)若用G装置收集氧气,检验氧气是否集满的方法是_____________________
(4)若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,可选用___代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,可用___ (填实验操作名称)的方法分离出二氧化锰。该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和___,其中玻璃棒的作用是___.
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有___.
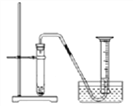
(6)化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为___.
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末___(选填“有”、“无”)催化作用,三者中___催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果___.
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___.
记录时间t3,且t1
更正结论为:当___时,反应物浓度越大,反应速率越快。
【答案】 酒精灯 集气瓶 D F或G 紫黑色 2KMnO4![]() K2MnO4+MnO2+O2↑ 带火星的木条放在集气瓶口,观察木条是否复燃 分液漏斗(注射器) 过滤 玻璃棒 引流 能溶于水且密度大于空气的性质取 取5mL10%H2O2溶液,记录数据 有 二氧化锰 t1<t2 取10mL5%H2O2溶液,加入0.5gCuO为催化剂,进行实验,记录时间t3 催化剂相同
K2MnO4+MnO2+O2↑ 带火星的木条放在集气瓶口,观察木条是否复燃 分液漏斗(注射器) 过滤 玻璃棒 引流 能溶于水且密度大于空气的性质取 取5mL10%H2O2溶液,记录数据 有 二氧化锰 t1<t2 取10mL5%H2O2溶液,加入0.5gCuO为催化剂,进行实验,记录时间t3 催化剂相同
【解析】本题主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写,用控制变量法探究影响化学反应速率的因素,综合性比较强。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关;用控制变量法设计对照实验时只允许有一个变量,其他量相同。
(1)图中标示的仪器名称分别为:①是酒精灯,②是集气瓶;
(2)实验室用KMnO4制取O2,是固体的加热反应,应选用的发生装置D;氧气的密度大于空气的密度,并且不易溶于水,所以可以用排水法和向上排空气法收集,所以要收集装置是F或G;KMnO4时是紫黑色粉末状药品,高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,化学方程式是:2KMnO4△ K2MnO4+MnO2+O2↑;
(3)氧气具有助燃性。氧气验满的方法是:将带火星的木条放在集气瓶口,若木条复燃,则证明已收集满;
(4) 若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,分液漏斗(注射器)可控制液体的滴加速率,可选用分液漏斗(注射器)代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,二氧化锰不溶于水,可用过滤的方法分离出二氧化锰;该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和漏斗,其中玻璃棒的作用是引流;
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有能溶于水且密度大于空气的性质;
(6) 证明红砖粉末有无催化作用,必须与没加催化剂时进行比较,所以需要补做实验:取5mL10%H2O2溶液,记录数据;通过对照实验可知,在没有使用红砖粉末时,耗时大于100s,收集到很少量气体,所以红砖粉末有催化作用;催化效率最高的物质,在相同条件下反应速率最快,由表中数据可知二氧化锰的催化效果最好;根据结论:浓度越大,反应速率越快。可知反应物浓度越高,反应速率越快,收集相同体积气体需要的时间越短,所以t1<t2;从丙同学的结论进行反推,催化剂不同时,进行对照,需要补充实验:取10mL5%H2O2溶液,加入0.5gCuO为催化剂,进行实验,记录时间t3;因为t1<t3<t2得出结论:催化剂相同时,反应物浓度越大,反应速率越快。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。可以说镍行业发展蕴藏着巨大的潜力。
Ⅰ制备草酸镍
工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍(NiC2O4)。
根据下列工艺流程图回答问题:
【资料卡片1】
(1)过氧化氢(H2O2)俗称双氧水,是一种液体,受热易分解,可用于实验室制取氧气;过氧化氢具有强氧化性,所以常作为氧化剂、漂白剂和消毒剂。
(2)氧化反应可以从元素化合价升降的角度进行分析:物质所含元素化合价升高的反应就是氧化反应。
(3)金属镍的化学性质类似于铁,与盐酸反应能生成氯化镍(NiCl2)。
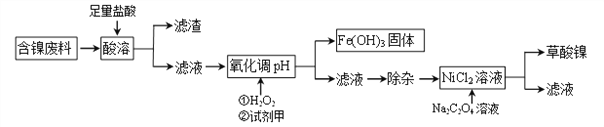
(1)“酸溶”之后的滤渣中含有的金属是_______________。
(2)写出酸溶过程中Ni与盐酸反应的化学方程式_________________________。
(3)加H2O2时,温度不能太高,其原因是_______________________。若H2O2在“酸溶”步骤即与盐酸同时加入,则与原方案相比滤液中会增加的金属离子是Cu2+和_______(写离子符号)。
(4)已知Na2C2O4溶液加入NiCl2溶液发生复分解反应,写出该反应的化学方程式____________。
Ⅱ制备镍粉
工业用电解镍液(主要含NiSO4)制备碱式碳酸镍晶体xNiCO3yNi(OH)2zH2O,并利用其制备镍粉,过程如下:
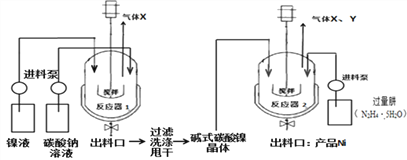
(5)反应器1中的一个重要反应为3NiSO4+3Na2CO3+2H2O ![]() NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
(6)反应器1的出料口获得的固体洗涤时,需用纯水洗涤,可以用来检验固体已洗涤干净的试剂是____________。
(7)反应器2中产生的气体Y是空气中含量最多的气体,该气体是_________(填名称)。
Ⅲ 测定碱式碳酸镍晶体的组成
为测定碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】组成,某小组设计了如下实验方案及装置:
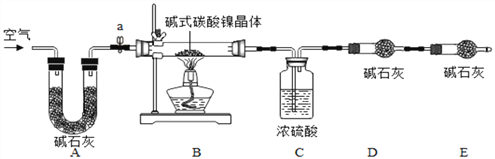
【资料卡片2】
(1)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O
(2)在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3
(3)碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
【实验步骤】
①检查装置气密性;②准确称取3.77g碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】
(9)计算3.77g碱式碳酸镍晶体【xNiCO3yNi(OH)2zH2O】中镍元素的质量_________(写出计算过程,计算结果准确到小数点后两位)。
【实验反思】
(10)另一小组同学在实验中发现,实验结束后,称得装置B中残留固体质量明显偏大,老师带领全组同学经过仔细分析后发现,这是由于该组同学加热时在酒精灯上加了铁丝网罩,温度过高所导致。请问该组同学称得的残留固体中镍元素的质量分数可能是__________。
A.70.08% B.75.88% C.78.67% D.79.58%