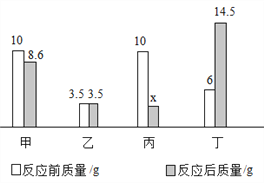
题目内容
【题目】实验是学习化学的一种重要途径。
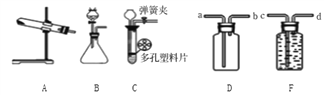
Ⅰ.图1是实验室制取气体常见的装置,据图回答有关问题。
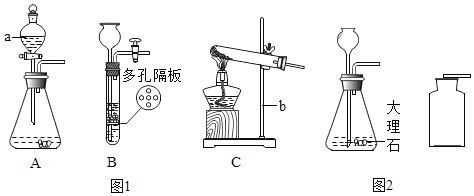
(1)写出下列仪器名称:a_________________,b_________________。
(2)实验室用氯酸钾和二氧化锰制取氧气,发生装置为_________________(填装置编号),发生反应的化学方程式为_______________________,收集氧气的操作如下,其正确顺序为_________________(填序号)。
①当气泡连续并比较均匀地放出时,再将导管口伸入盛满水的集气瓶
②当气体收集满时,在水面下用玻璃片盖住瓶口,移出水面正放在桌面上
③将集气瓶盛满水,用玻璃片盖住瓶口,倒立在盛水的水槽内
Ⅱ.钙元素是人体中重要的微量元素,钙元素组成的化合物种类有很多。某实验探究小组想研究一些含钙化合物的性质,请你一起参与。
(1)人体中缺少钙元素易得_______________病。
(2)氧化钙溶于水制得熟石灰,氧化钙常用作_______________剂。
(3)氢化钙(CaH2)固体是登山运动员常用的能源提供剂,小明同学将一定量稀盐酸滴入盛有氢化钙固体的锥形瓶中立刻观察到有大量气泡冒出,一段时间后变成澄清的溶液。
【提出问题】①生成的气体是什么?
②澄清溶液中溶质的成分是什么?
【查阅资料】①氢化钙是一种灰白色固体,CaH2能与水反应生成Ca(OH)2和一种可燃性气体。
②CaCl2溶液显中性。
【猜想气体】小张认为气体为CO,小明立刻否定。你认为他的理由是________。请你写出CaH2与水反应的化学方程式:____________________。
【猜想溶质】猜想一:只有CaCl2;
猜想二:有_______________(填化学式);
猜想三:有CaCl2和Ca(OH)2。
【实验探究】为了验证猜想二,他们分别进行了下列三组实验:
实验①:取少量溶液置于试管中,滴加紫色石蕊试液,观察到溶液颜色变成___色,则猜想二正确。
实验②:取少量溶液置于试管中,加入__________,观察到有气泡冒出,则猜想二正确。
实验③:取少量溶液置于试管中,加入CuO粉末,观察到_____________,则猜想二正确。
【得出结论】通过上述三组实验的探究,两位同学一致确定猜想二正确。
【评价反思】在分析反应后所得溶液中溶质的成分时,除考虑生成物外,还需要考虑______________________________。
【答案】 分液漏斗 铁架台 C 2KClO3![]() 2KCl+3O2↑ ③①② 佝偻病、骨质疏松等 干燥 反应物中不含有碳元素,不能生成一氧化碳 CaH2+2H2O
2KCl+3O2↑ ③①② 佝偻病、骨质疏松等 干燥 反应物中不含有碳元素,不能生成一氧化碳 CaH2+2H2O![]() Ca(OH)2+2H2↑ CaCl2和HCl 红 活泼金属或碳酸盐 粉末溶解,溶液由无色变为蓝色 反应物是否有剩余
Ca(OH)2+2H2↑ CaCl2和HCl 红 活泼金属或碳酸盐 粉末溶解,溶液由无色变为蓝色 反应物是否有剩余
【解析】Ⅰ.图1是实验室制取气体常见的装置。根据所学知识和题中信息知,(1)仪器名称:a分液漏斗,b铁架台。(2)实验室用氯酸钾和二氧化锰制取氧气,发生装置为C,固体和固体反应加热制取气体,发生反应的化学方程式为2KClO3![]() 2KCl+3O2↑。收集氧气的操作如下,其正确顺序为③将集气瓶盛满水,用玻璃片盖住瓶口,倒立在盛水的水槽内,①当气泡连续并比较均匀地放出时,再将导管口伸入盛满水的集气瓶,②当气体收集满时,在水面下用玻璃片盖住瓶口,移出水面正放在桌面上。Ⅱ.探究含钙化合物的性质。(1)人体中缺少钙元素易得佝偻病、骨质疏松等,钙是骨骼的重要组成物质。(2)氧化钙溶于水制得熟石灰,氧化钙常用作干燥剂。(3)氢化钙(CaH2)固体是登山运动员常用的能源提供剂,将一定量稀盐酸滴入盛有氢化钙固体的锥形瓶中立刻观察到有大量气泡冒出,一段时间后变成澄清的溶液。【提出问题】①生成的气体是什么? ②澄清溶液中溶质的成分是什么?根据质量守恒定律知,【猜想气体】气体为CO,小明立刻否定。他的理由是反应物中不含有碳元素,不能生成一氧化碳。CaH2与水反应的化学方程式:CaH2+2H2O=Ca(OH)2+2H2↑。【猜想溶质】猜想一:只有CaCl2;猜想二:有CaCl2和HCl;猜想三:有CaCl2和Ca(OH)2。【实验探究】实验①:取少量溶液置于试管中,滴加紫色石蕊试液,观察到溶液颜色变成红,说明溶液呈酸性,,则猜想二正确,盐酸呈酸性。实验②:取少量溶液置于试管中,加入活泼金属或碳酸盐,观察到有气泡冒出,则猜想二正确,活泼金属或碳酸盐均与盐酸反应生成气体氢气或二氧化碳。实验③:取少量溶液置于试管中,加入CuO粉末,观察到粉末溶解,溶液由无色变为蓝色,CuO粉末与盐酸反应生成氯化铜和水,氯化铜溶液呈蓝色,则猜想二正确。【得出结论】猜想二正确。【评价反思】在分析反应后所得溶液中溶质的成分时,除考虑生成物外,还需要考虑反应物是否有剩余。
2KCl+3O2↑。收集氧气的操作如下,其正确顺序为③将集气瓶盛满水,用玻璃片盖住瓶口,倒立在盛水的水槽内,①当气泡连续并比较均匀地放出时,再将导管口伸入盛满水的集气瓶,②当气体收集满时,在水面下用玻璃片盖住瓶口,移出水面正放在桌面上。Ⅱ.探究含钙化合物的性质。(1)人体中缺少钙元素易得佝偻病、骨质疏松等,钙是骨骼的重要组成物质。(2)氧化钙溶于水制得熟石灰,氧化钙常用作干燥剂。(3)氢化钙(CaH2)固体是登山运动员常用的能源提供剂,将一定量稀盐酸滴入盛有氢化钙固体的锥形瓶中立刻观察到有大量气泡冒出,一段时间后变成澄清的溶液。【提出问题】①生成的气体是什么? ②澄清溶液中溶质的成分是什么?根据质量守恒定律知,【猜想气体】气体为CO,小明立刻否定。他的理由是反应物中不含有碳元素,不能生成一氧化碳。CaH2与水反应的化学方程式:CaH2+2H2O=Ca(OH)2+2H2↑。【猜想溶质】猜想一:只有CaCl2;猜想二:有CaCl2和HCl;猜想三:有CaCl2和Ca(OH)2。【实验探究】实验①:取少量溶液置于试管中,滴加紫色石蕊试液,观察到溶液颜色变成红,说明溶液呈酸性,,则猜想二正确,盐酸呈酸性。实验②:取少量溶液置于试管中,加入活泼金属或碳酸盐,观察到有气泡冒出,则猜想二正确,活泼金属或碳酸盐均与盐酸反应生成气体氢气或二氧化碳。实验③:取少量溶液置于试管中,加入CuO粉末,观察到粉末溶解,溶液由无色变为蓝色,CuO粉末与盐酸反应生成氯化铜和水,氯化铜溶液呈蓝色,则猜想二正确。【得出结论】猜想二正确。【评价反思】在分析反应后所得溶液中溶质的成分时,除考虑生成物外,还需要考虑反应物是否有剩余。
点睛∶这是一道实验探究题,探究含钙化合物的性质。滴加紫色石蕊试液,观察到溶液颜色变成红,说明溶液呈酸性。CuO粉末与盐酸反应生成氯化铜和水,氯化铜溶液呈蓝色。

【题目】锂、锰两种金属用途很广。
(1)手机电池中存在LiMnO2,已知锂元素显+1价,则锰元素的化合价为___。电池充电时是将电能转化为__(填字母):A.机械能 B.化学能 C.热能
(2)锂、锰的碳酸盐也有广泛的用途。
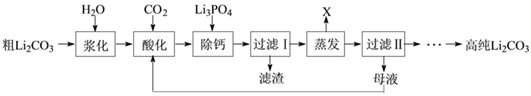
Ⅰ.粗碳酸锂(含有Na+、K+、Ca2+等杂质离子)制备高纯碳酸锂的工艺流程如下:(已知碳酸锂能与水、二氧化碳反应生成碳酸氢锂,碳酸氢锂不稳定,受热后会分解为碳酸锂)
碳酸锂易溶于水,碳酸锂溶解度与温度的关系见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
①浆料“酸化”时,温度不宜超过25℃的主要原因是______。判断酸化过程已经结束的明显现象为______。
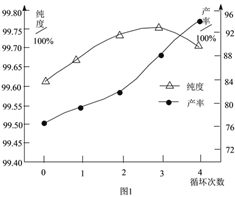
②“蒸发”时主要反应的化学方程式为______。母液循环次数对纯度、产率的影响如图1所示,循环不宜超过______次,主要原因是______。
③为了获得较多高纯Li2CO3,过滤Ⅱ后用______(填“热水”或“冷水”)洗涤沉淀2-3次,并干燥。其原因是____。
Ⅱ.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
已知:MnCO3难溶于水和乙醇,受热易分解。
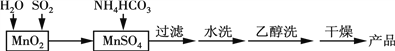
①检验水洗是否完全的方法是______。
②水洗结束后,用乙醇洗涤的目的是______。
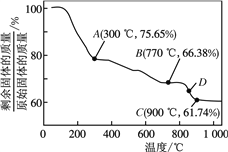
③MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如下图所示。通过计算可知,300℃时,剩余固体中n(Mn)∶n(O)=1:2,即可认为A物质化学式为MnO2,同时测得反应生成了二氧化碳,请写出0~300℃发生反应的化学方程式______。图中点D对应固体的成分为_____(填化学式,并写出计算过程)。