题目内容
【题目】请运用所学化学知识填空:
(1)拉瓦锡通过实验测得,氧气约占空气体积的________;硫在氧气燃烧会伴随___________色火焰。
(2)从微观视角看,“春雨丽润泽桃花开,微风拂面清香来”说明_________; CH3COOH、HCl等物质的水溶液都能使石蕊溶液变为红色的原因是:它们的溶波中都含有_________(填微粒名称)。
(3)构成硫酸铁的阳离子符号为:_________;甲烷完全燃烧的化学方程式为:___________________。
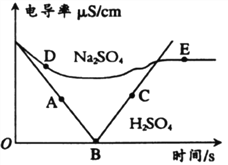
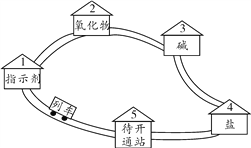
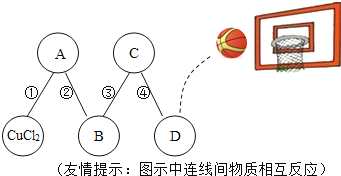
(4)依据下图回答问题:
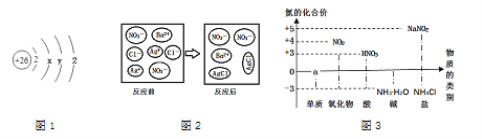
①图1中y的值为________
②另写1个与图2所示微观反应本质相同的化学方程式_____________·
③写出图3中a处的1种物质名称:_____________,其中位置放错的物质有:___________(填化学式)。
【答案】 1/5 蓝紫 构成物质的微粒是不断运动的 氢离子 Fe3+ CH4 + 2O2 ![]() CO2 +2H2O 14 NaCl + AgNO3 = AgCl ↓+ NaNO3 氮气 HNO3、NaNO2
CO2 +2H2O 14 NaCl + AgNO3 = AgCl ↓+ NaNO3 氮气 HNO3、NaNO2
【解析】(1)根据氧气约占空气体积的五分之一解答;根据硫在氧气燃烧产生蓝紫色火焰解答;(2)根据构成物质的微粒是不断运动的解答;根据能使石蕊溶液变为红色的物质显酸性,酸性物质中含有氢离子解答;(3)根据硫酸铁中的阳离子为铁离子解答;根据甲烷和氧气在点燃的条件下反应生成二氧化碳和氧气解答;(4) ①根据原子核外电子的排布规律及原子中质子数=电子数解答;②根据硝酸银与盐酸盐反应生成氯化银沉淀解答;③根据氮元素组成的单质为氮气解答;根据氮元素的化合价分析解答。(1)拉瓦锡通过实验测得,氧气约占空气体积的![]() ;硫在氧气燃烧会伴随明亮的蓝紫色火焰;(2)从微观视角看,“春雨丽润泽桃花开,微风拂面清香来”说明构成物质的微粒是不断运动的;CH3COOH、HCl等物质的水溶液都能使石蕊溶液变为红色的原因是:它们的溶波中都含有氢离子;(3) 硫酸铁中的阳离子为铁离子,离子符号为Fe3+;甲烷完全燃烧的化学方程式为CH4+2O2点燃2H2O+CO2;(4) ①根据原子核外电子的排布规律可知,第二层排8个,即x=8,又原子中质子数=电子数,即26=2+8+y+2,y=14;②硝酸银与盐酸盐反应生成氯化银,如NaCl+AgNO3=AgCl+NaNO3;③氮元素组成的单质为氮气,故图3中a处的1种物质名称氮气;NO2中氮元素的化合价为+4价,正确;HNO3中氮元素的化合价为+5价,错误;NH3H2O中氮元素的化合价为-3价,正确;NaNO2中氮元素的化合价为+3价,错误;NH4Cl中氮元素的化合价为-3价,正确。故其中位置放错的物质有HNO3、NaNO2。
;硫在氧气燃烧会伴随明亮的蓝紫色火焰;(2)从微观视角看,“春雨丽润泽桃花开,微风拂面清香来”说明构成物质的微粒是不断运动的;CH3COOH、HCl等物质的水溶液都能使石蕊溶液变为红色的原因是:它们的溶波中都含有氢离子;(3) 硫酸铁中的阳离子为铁离子,离子符号为Fe3+;甲烷完全燃烧的化学方程式为CH4+2O2点燃2H2O+CO2;(4) ①根据原子核外电子的排布规律可知,第二层排8个,即x=8,又原子中质子数=电子数,即26=2+8+y+2,y=14;②硝酸银与盐酸盐反应生成氯化银,如NaCl+AgNO3=AgCl+NaNO3;③氮元素组成的单质为氮气,故图3中a处的1种物质名称氮气;NO2中氮元素的化合价为+4价,正确;HNO3中氮元素的化合价为+5价,错误;NH3H2O中氮元素的化合价为-3价,正确;NaNO2中氮元素的化合价为+3价,错误;NH4Cl中氮元素的化合价为-3价,正确。故其中位置放错的物质有HNO3、NaNO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室需配置一定浓度的硝酸钾溶液。
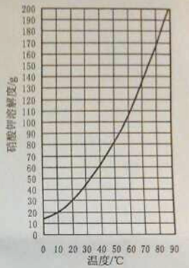
(1) 查阅硝酸钾溶解性。由右图可知,20℃时,硝酸钾的溶解度为 g,在该温度下配制硝酸钾溶液,溶质质量分数最大为 %(计算结果保留整数)。
(2)计算。配置40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1g/mL)。
(3)称量。分别在天平左右两盘放上纸片,调节平衡后, (填字母)。
A、先移动游码到所需位置,再添加硝酸钾直到天平平衡
B、先添加所需的硝酸钾,再移动游码直到天平平衡
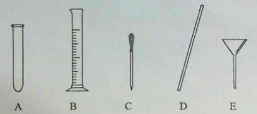
(4)量取。量取所需蒸馏水要用到的仪器是 (填字母)。
(5)溶解。将称量好的硝酸钾和蒸馏水混合溶解。
(6)稀释。20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液。从下表中找出需要用到的数据: g/mL。
硝酸钾溶液的密度(单位1g/mL)
质量分数/% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
【题目】如图所示,在a烧杯中盛有酚酞溶液,在b烧杯中盛有浓氨水,有关现象和解释正确的是
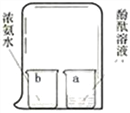
选项 | 现象 | 解释 |
A | a烧杯溶液变红色 | b中氨气分子运动到a中,氨气溶于水,氨水呈碱性 |
B | a烧杯溶液变红色 | 氨气与酚酞反应生成红色物质 |
C | b烧杯溶液变红色 | b中氨气分子没有运动 |
D | b烧杯溶液变红色 | a中酚酞分子运动到b中,氨水呈中性 |
A. A B. B C. C D. D