题目内容
【题目】实验室中有 5 种没有标签的溶液,分别是Na2CO3、NaCl、Ca(OH)2、NaOH和稀盐酸,老师让化学实验小组同学鉴别这些溶液。
(查阅资料)无色、有刺激性气味的氯化氢气体溶于水得到盐酸。
(研究方式)从5种无色溶液中任意取出4种为一组进行鉴别。
(提出假设)同学们从5种无色溶液中取出4种,贴上A、B、C、D 标签,并且假设这一组溶液可能是Na2CO3、NaCl、Ca(OH)2、和稀盐酸。
(实验探究)同学们按以下步骤进行鉴别。
(第一步)取 4 支试管,分别加入少量的 A、B、C、D 溶液,然后依次加入少量稀盐酸,实验现象 记录见下表:
溶液 | A | B | C | D |
加入稀盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
①实验结论:C是_______溶液。
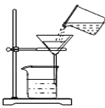
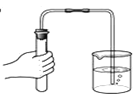
(第二步)依据下图装置进行实验,其中夹持固定装置已略去。从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化。
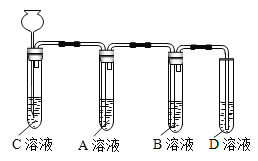
②实验结论:A是_______溶液。
(第三步)取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热。再取少量D溶液倒入另 一蒸发皿,加热,有白色固体析出,停止加热。
③实验结论:B是稀盐酸,D是NaCl溶液。
经过上述三步实验,同学们认为第 5 种无色溶液是NaOH溶液。
(实验反思)老师引导同学们讨论了上述实验探究过程并进行了全面反思。
①老师指出:实验结论仍有不确定性。不能确定的是_____溶液,其鉴别方法是________
②老师提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B 溶液,请在下列实验报告 中简述其实验步骤、现象和结论。
实验步骤 | 实验现象和结论 |
_______ | __________ |
【答案】Na2CO3 Ca(OH)2 NaOH和NaCl 取D液于试管中,滴加无色酚酞,若酚酞变红,则溶液中的溶质为NaOH;若酚酞不变红,则溶液中的溶质为NaCl。 将碳酸钠溶液分别加入到A、B溶液中 A中生成白色沉淀,则A中溶质为Ca(OH)2,B中产生气泡,则B中溶质为HCl。
【解析】
实验探究:①Na2CO3+2HCl═2NaCl+CO2↑+H2O;
②Na2CO3+2HCl═2NaCl+CO2↑+H2O,CO2+Ca(OH)2=CaCO3↓+H2O;
实验反思:①D中原来可能盛有的是氯化钠溶液或氢氧化钠溶液;
②氢氧化钠会与二氧化碳反应生成碳酸钠,可检验碳酸根离子来判断。
实验探究:①从长颈漏斗中加入盐酸,C中产生气泡,说明C中盛有的是碳酸钠溶液;
②碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,产生的二氧化碳倒入A中产生白色沉淀,说明A中盛有的是氢氧化钙溶液,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水;
实验反思:①D中原来可能盛有的是氯化钠溶液,也可能是盛有的氢氧化钠溶液。可以取D液于试管中,滴加无色酚酞,若酚酞变红,则溶液中的溶质为NaOH;若酚酞不变红,则溶液中的溶质为NaCl;
②Na2CO3与Ca(OH)2会生成白色沉淀,Na2CO3与HCl会产生气泡。故实验步骤:将碳酸钠溶液分别加入到A、B溶液中。实验现象和结论:A中生成白色沉淀,则A中溶质为Ca(OH)2,B中产生气泡,则B中溶质为HCl。

 阅读快车系列答案
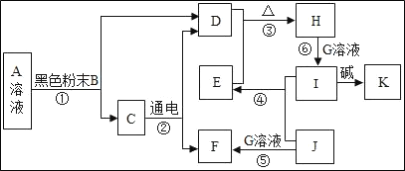
阅读快车系列答案【题目】某混合气体可能有CO2、CO、H2中的一种或几种,某学习小组的同学为了探究气体的组成,设计了如下装置进行实验(夹持装置已省略)。实验后发现A装置中 溶液变浑浊,C中的固体由黑色变红色,D中的固体由白色变蓝色,F装置中有水流入烧杯。在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如下表:
反应前后 | 反应前 | 反应后 |
C装置中的试管与固体的总质量(克) | a | c |
D装置的中U形管与固体的总质量 | b | d |
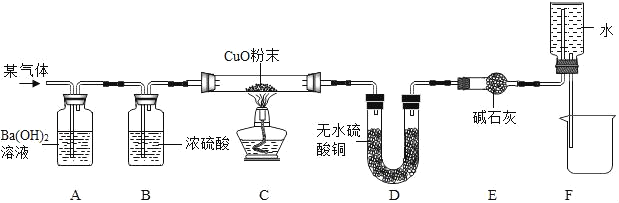
请分析回答下列问题;
(1)请写出A装置中反应的化学方程式_____。
(2)一定能证明原混合气体中有氢气存在的实验现象是_____。
(3)证明原混合气体中有CO存在的定量关系式是_____(用字母a、b、c、d表示)