题目内容
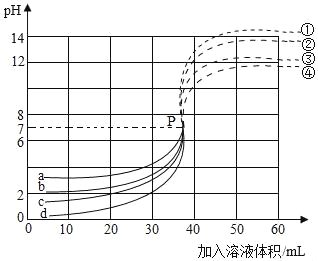
【题目】下图是A物质(不含结晶水)的溶解度曲线.

(1)A物质的溶解度随随的升高而_____(选填“增大”、“减小”或“不变”.)
(2)在t2℃时,将15gA物质放入50g水中,搅拌,充分溶解后,形成的溶液溶质质量分数为_____;
(3)N点表示t3℃时A物质的_____(填“饱和”或“不饱和”)溶液;
(4)如下是M、N两点代表的溶液相互转化的途径路线图(“…>”表示转化方向).
其中,采取“先将M点溶液加入一定量的水后,然后再升高温度至N点对应的温度”这一措施来实现M→N转化的途径路线图是_____(填序号);根据甲图来实现N→M转化,应采取的措施是_____.

【答案】增大 20% 不饱和 丁 先将N点溶液降低温度至M点对应的温度,再向溶液中加入溶质固体或再恒温蒸发溶剂 .
【解析】
(1)A物质的溶解度曲线随温度升高而上升,说明物质A的溶解度随温度升高而增大;
(2)t2℃时物质A的溶解度为25g,即100g水最多可以溶解25g物质A;现将15gA物质放入50g水中,搅拌充分溶解后,仍有15g﹣12.5g=2.5g固体A物质剩余而不能溶解,即此时所得溶液为该温度下的饱和溶液,则所得溶液的溶质质量分数=![]() =20%;
=20%;
(3)N点位于物质A的溶解度曲线下方,表示此点所示溶液为不饱和溶液;
(4)M点为t2℃时物质A的饱和溶液,先将M点溶液加入一定量的水后,溶液温度不变而加水变成了不饱和溶液,因此M点竖起下降;然后再升高温度至N点对应的温度,只升高溶液的温度因此M点继续向右平移至N点;此过程与丁图所示一致;
甲图所示,N点先平移再竖起向上移动至M,平移说明此时只是对溶液降温,溶液组成不变;降温后点仍位于曲线下方,仍为不饱和溶液,此时可通过增加溶质或恒温蒸发溶剂,在不改变温度的情况下,使点竖起上升至M而变成饱和溶液;
故答案为:(1)增大;(2)20%;(3)不饱和;(4)丁;先将N点溶液降低温度至M点对应的温度,再向溶液中加入溶质固体或再恒温蒸发溶剂.

【题目】(1)某研究性学习小组为验证“氨气还原氧化铜”的实验,认真阅资料并做出以下准备。
资料准备:I.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
Ⅱ.氨气还原氧化铜的化学反应原理:2NH3+3CuO![]() 3Cu+N2+3H2O。
3Cu+N2+3H2O。
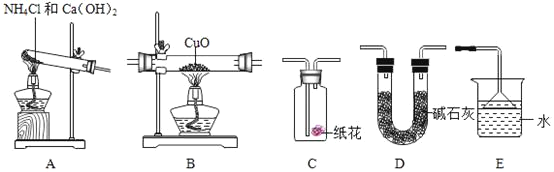
实验准备:
请回答:
①为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序_____;(填序号)
②装置A中发生反应的化学方程式_____;
③装置B观察到的现象_____,装置E的作用_____;
④将装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变蓝色,原因是_____。
(2)金属镁可与热水反应生成氢氧化镁和氢气,所得溶液呈碱性,可使酚酞溶液显紅色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
①镁与热水反应的化学方程式是_____。
②查阅资料:溶液红色褪去的原因是溶液碱性减弱。
(提出问题)导致溶液碱性减弱的原因是什么?
(假设与分析)
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的_____。
假设3:可能是氢氧化镁的溶解度随温度的降低而_____。
由碱的性质可知,假设1不成立。
(实验探究)
实验操作 | 实验现象 | 结论 |
(1)取上述红色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | _____ | 假设2成立 |
(2)取上述红色溶液,_____,_____,观察现象。 | 红色褪去 | 假设3成立 |
(拓展延伸)
③将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。
请解释其原因:_____。
④除上述金属外,根据金属活动性顺序,预测_____也能跟硫酸铜溶液反应产生上述现象(举一例即可)。