题目内容
【题目】小朱同学分别用溶质质量分数为3.65%、0.365%、0.0365%、0.00365%的稀盐酸各30mL,分别与不同浓度的NaOH溶液反应,测定4个反应过程中的pH,绘制成如图象。
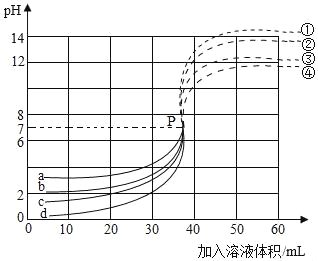
(1)写出实验时发生反应的化学方程式_____,用溶质质量分数为3.65%的稀盐酸进行实验时溶液温度的变化是_____
(2)曲线c代表的实验所用的是ω=_____的稀盐酸,加入20 mLNaOH溶液时,溶液中主要存在的离子是_____(填离子符号)。
(3)曲线a代表的反应在P点后对应的曲线是_____(填①、②、③、④)。
【答案】HCl+NaOH═NaCl+H2O 升高 0.365% Na+、H+、Cl﹣ ①
【解析】
(1)盐酸与氢氧化钠发生中和反应生成氯化钠和水;酸碱中和反应放出热量,所以用溶质质量分数为3.65%的稀盐酸进行实验时溶液温度升高;故填:HCl+NaOH═NaCl+H2O;升高;
(2)稀盐酸的浓度越大,其酸性越强,pH越小,由图可知,曲线c代表的实验所用的是0.365%的稀盐酸;加入20 mLNaOH溶液时,溶液的pH<7,显酸性,溶液中主要存在的离子是钠离子、氢离子和氯离子;故填:0.365%;Na+、H+、Cl﹣;
(3)曲线a代表是0.00365%的稀盐酸,滴加氢氧化钠溶液时,它的pH变化最为明显,即在P点后对应的曲线是①;故填:①。

【题目】元素周期表和化学用语都是学习化学的重要工具,回答下列问题
(1)第9号元素的气体单质(该物质的一个分子由两个原子构成)常温下与水发生反应,生成氢氟酸(HF)和另一种具有助燃性的常见气体单质,该反应的化学方程式为_____
(2)中和反应在生产生活中应用广泛
①含有第3号元素的碱,其化学式为_____,其溶液因为含有_____(填微粒符号)而具有碱性,H2SiO3属于_____(填物质类别),推测这两种物质间发生反应的化学方程式为_____
②氢氧化钾溶液与稀硫酸发生反应的化学方程式为_____,恰好完全反应后的溶液因存在_____(填微粒符号)而具有导电性.
③下表是某酸碱指示剂在不同的pH值范围内显示的颜色
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
pH范围 | 1~3 | 4~5 | 6~7 | 8~10 | 11~14 |
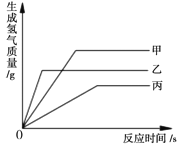
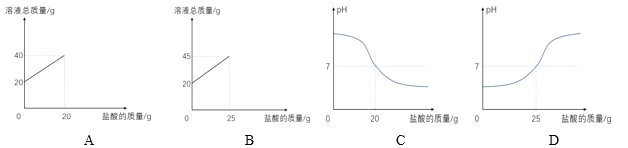
某同学用10%的氢氧化钠溶液、7.3%的稀盐酸和上述指示剂做中和反应的实验,当观察到烧杯中颜色恰好由蓝变绿时氢氧化钠溶液反应消耗了20g,则下列图像正确的是_____(填序号)
【题目】(1)如图是实验室制取气体的一些装置,据图回答:
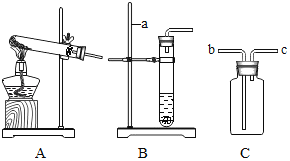
①如图仪器a的名称是_____。
②用高锰酸钾制取氧气的化学方程式是_____。若用C装置收集氧气,验满时,应将带火星的木条放在_____(填“b”或“c”)端导管口,若木条复燃,说明氧气已满。
(2)某校化学兴趣小组在学完碱的化学性质后,做了澄清石灰水和稀盐酸反应的实验,并将废液倒入一洁净的废液缸中,进行了如下探究:
探究Ⅰ:甲同学在做实验时没有观察到明显现象,于是对澄清石灰水和稀盐酸能否发生反应表示怀疑,乙同学认为,甲同学实验时应先向澄淸石灰水中滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到_____时,就可以说明两种物质能发生反应。
探究Ⅱ:废液中溶质的成分是什么?
(做出猜想)
猜想一:CaCl2
猜想二:CaCl2、HCl
猜想三:CaCl2、HCl、Ca(OH)2
你的猜想:_____
丙同学认为猜想三是错误的,理由是_____(用化学方程式解释)。
(实验设计)
设计者 | 实验操作 | 实验现象 | 实验结论 |
丁同学 | 取少量废液于一支试管中,向其中加入足量的碳酸钠溶液 | 有白色沉淀生成 | 猜想一正确 |
戊同学 | 取几粒锌粒于一支试管中,向其中加入少量废液 | _____ | 猜想二正确 |
(评价与反思)请判断以上设计的两个方案中,_____同学的方案合理,请分析另一个方案不合理的理由:_____。
(表达与交流)若实验证明猜想二是正确的,你认为该废液来经处理直接倒入下水道,可能造成的危害是_____(填一点)。