题目内容
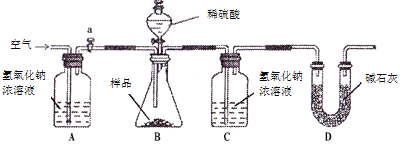
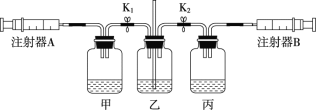
【题目】利用下图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。
已知:2NH3 + H2SO4 = (NH4)2SO4;(NH4)2SO4为白色固体。
实验步骤 | 实验操作 | 实验现象 |
① | 打开K1,关闭K2,缓慢拉注射器A活塞 | 甲中液面上方无明显现象 |
② | 打开K2,关闭K1,缓慢拉注射器B活塞 | 丙中液面上方出现大量白烟 |
(1)丙中发生化合反应,生成大量白烟(NH4Cl)的化学方程式为________。
(2)该实验能够得出的结论是________。
(3)从微观角度解释甲中无白烟,而丙中出现白烟的原因是__________。
【答案】NH3 + HCl = NH4Cl 浓硫酸没有挥发性,浓盐酸具有挥发性 氨分子运动到甲、丙液面上方,甲中硫酸分子没有运动到液面上方与氨分子接触,而丙中氯化氢分子运动到液面上方并与氨分子接触反应生成氯化铵,故甲中无白烟,丙中出现白烟
【解析】
(1)打开K2,关闭K1,缓慢拉注射器B活塞,把乙中的气体分子拉入到丙中,丙中氨气和氯化氢化合生成白色固体氯化铵,故生成大量白烟(NH4Cl)的化学方程式为:NH3 + HCl = NH4Cl;故填:NH3 + HCl = NH4Cl
(2)该实验是要验证浓硫酸、浓盐酸的挥发性,而通过步骤①,甲中液面上方无明显现象,说明浓硫酸没有挥发到气体中,故没有在液面上反应,可以证明浓硫酸没有挥发性,而通过步骤②,丙中液面上方出现大量白烟说明盐酸分子挥发到空气中了,在空气中遇到氨气分子,结合生成了大量的白烟。通过这两个实验步骤证明:浓硫酸没有挥发性,浓盐酸具有挥发性;故填:浓硫酸没有挥发性,浓盐酸具有挥发性
(3)甲中无白烟,而丙中出现白烟的微观原因是:氨分子运动到甲、丙液面上方,甲中硫酸分子没有运动到液面上方与氨分子接触,而丙中氯化氢分子运动到液面上方并与氨分子接触反应生成氯化铵,故甲中无白烟,丙中出现白烟。故填:氨分子运动到甲、丙液面上方,甲中硫酸分子没有运动到液面上方与氨分子接触,而丙中氯化氢分子运动到液面上方并与氨分子接触反应生成氯化铵,故甲中无白烟,丙中出现白烟

 阅读快车系列答案
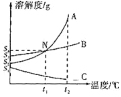
阅读快车系列答案【题目】分析处理图表信息是学习的一种重要方法。如表是氯化钠、硝酸钾、氢氧化钙在不同温度下的溶解度。这三种固体物质的溶解度曲线如图所示。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
Ca(OH)2 | 0.16 | 0.14 | 0.12 | 0.095 | |
请仔细阅读图表后回答下列问题:
(1)A曲线表示的是_____的溶解度曲线。
(2)除去A中少量的B,步骤是:加水溶解,蒸发浓缩,_____,过滤,洗涤,干燥。
(3)20℃时,将氯化钠、硝酸钾、氢氧化钙各10g分别加入盛有50g水的烧杯中,充分溶解,测得三种溶液中溶质的质量分数分别为a%、b%、c%,则三者之间的大小关系是_____。
(4)现有一杯饱和溶液,是A、B、C三种饱和溶液中的一种,将其加热时出现浑浊现象,则这杯饱和溶液的溶质是_____。
【题目】难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
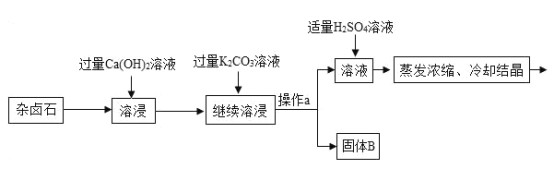
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的___;发生反应的化学方程式是___。
(2)操作a的名称是___。
(3)请写出固体B的两种主要成分___、___(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
a | 25 | 2.5 | 72.4 |
b | 40 | 2.5 | 86.55 |
c | 40 | 3 | 90.02 |
d | 60 | 3 | 91.98 |
e | 60 | 4 | 91.45 |
①上述实验的数据中,温度与K+浸取率的关系是___。
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是___℃和Ca(OH)2___g。