题目内容
【题目】下图是a、b、c三种物质的溶解度曲线。
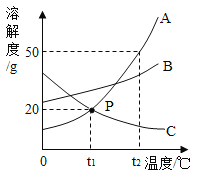
(1)b溶液在点P时处于__________ (填“ 饱和”或“不饱和”)状态。
(2)t2°C时,将一定量a物质完全溶解到水中,所得溶液恰好饱和。欲进一步提高该溶液的溶质质量分数,可进行的操作是____________________。
(3) t2 °C时,将a、b、c三种物质的饱和溶液降温至t1°C,下列说法正确的是____________(填序号)。
A 析出固体的质量a>b,c无固体析出
B 溶剂的质量:a<b<c
C a、b是饱和溶液,c是不饱和溶液
【答案】不饱和 升温且加溶质a C
【解析】
(1)由溶解度曲线的含义可知,溶解度曲线下方的点对应的溶液为不饱和溶液,由图可知,P点在b溶解度曲线的下方,所以b溶液在点P时处于不饱和状态,故填不饱和。
(2)由图可知,a的溶解度随温度升高而增大,提高a溶液的溶质质量分数,可以使a溶液在更高温度时处于饱和状态,所以采取的方法是升温后向溶液中加溶质a至饱和,故填升温且加溶质a。
(3)A 由图可知,a、b的溶解度均随温度升高而增大,降温后两种物质的溶解度均减小而析出晶体,但题目中没有指明两种物质的饱和溶液的质量关系,所以无法计算出析出晶体质量的多少,c的溶解度随温度升高而减小,所以降温后c的溶解度增大,溶液由饱和溶液转化为不饱和溶液,没有晶体析出,选项错误;
B 题目中没有指明三种物质的饱和溶液的质量关系,仅根据溶解度的大小无法确定溶液中溶剂的多少,选项错误;
C 由图可知,a、b的溶解度均随温度升高而增大,降温后两种物质的溶解度均减小,溶液仍为饱和溶液,,c的溶解度随温度升高而减小,所以降温后c的溶解度增大,溶液由饱和溶液转化为不饱和溶液,选项正确,故填C。

 阅读快车系列答案
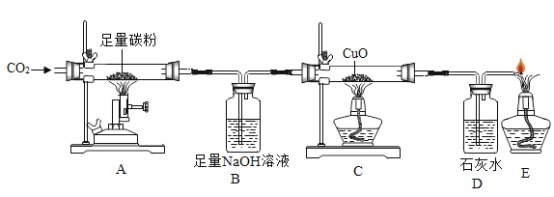
阅读快车系列答案【题目】过氧化钠(Na2O2)是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中的过氧化钠药品成分进行探究。
(查阅资料)①在点燃条件下,钠在空气中燃烧生成纯度较高的Na2O2
② 2Na2O2+2H2O = 4NaOH+O2↑ 2Na2O2+2CO2 = 2Na2CO3+O2
③金属钠遇水会发生剧烈反应生成H2
I.过氧化钠的制备
研究小组设计如图的装置进行实验室制备过氧化钠。
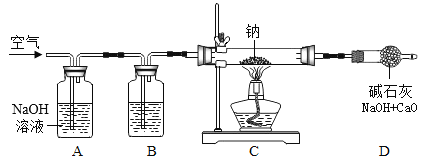
(1)装置B中的试剂是__。
(2)装置C中反应的化学方程式为__。
(3)装置D的作用是__。
II.开封已久的过氧化钠药品的成分测定
(定性检测)检测药品的成分。
(4)请补充完成下列实验报告中的相关内容。
实验序号 | 实验步骤 | 实验现象 | 解释或结论 |
① | 取少量固体样品于试管中,加入适量的水 | 样品全部溶解,无气泡产生 | 不含____ |
② | 取适量①中的溶液于试管中,加入过量的BaCl2溶液 | 有白色沉淀产生 | 化学方程式为___ |
③ | 待②充分静置后,向上层清液中滴入_____ | ____ | 含有氢氧化钠 |
(定量检测)检测药品的组成。
实验④:称取9.30g开封已久的过氧化钠样品于试管中,加入足量的稀硫酸,将产生的气体全部鼓入到足量的澄清石灰水中,过滤、洗涤、干燥,得到碳酸钙固体5.00g。
(5)计算确定样品中氢氧化钠的质量分数_____(写出计算过程,计算最后结果精确到0.1%)。
【题目】甲、乙两种固体在不同温度时的溶解度如下表所示。请回答下列问题:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度(g) | 甲 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
乙 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | |
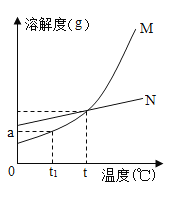
(1)依据上表数据,绘制出甲、乙两物质的溶解度曲线(如图所示),图中能表示甲物质溶解度曲线的是______;(填“M”或“N”)
(2)若t1=10℃,则a=________;
(3)40℃时,将30g甲物质溶于50g水中,充分搅拌,所得溶液中溶质的质量分数是_______(精确到0.1%);
(4)从甲、乙混合溶液中提纯乙的方法是________;
(5)t℃时甲、乙两物质的溶解度相等,此时t的取值范围是______。
A. 10~20 B. 20~30 C. 30~40 D. 40~50