题目内容
【题目】甲、乙两种固体在不同温度时的溶解度如下表所示。请回答下列问题:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度(g) | 甲 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
乙 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | |
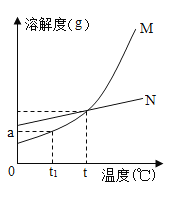
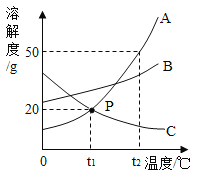
(1)依据上表数据,绘制出甲、乙两物质的溶解度曲线(如图所示),图中能表示甲物质溶解度曲线的是______;(填“M”或“N”)
(2)若t1=10℃,则a=________;
(3)40℃时,将30g甲物质溶于50g水中,充分搅拌,所得溶液中溶质的质量分数是_______(精确到0.1%);
(4)从甲、乙混合溶液中提纯乙的方法是________;
(5)t℃时甲、乙两物质的溶解度相等,此时t的取值范围是______。
A. 10~20 B. 20~30 C. 30~40 D. 40~50
【答案】N 20.9 28.6% 冷却热饱和溶液 B
【解析】
(1)根据上表数据可知:甲、乙两物质的溶解度均随温度升高而增大,但乙物质的溶解度增大的较快,所以甲物质的溶解度曲线是N,乙物质的溶解度曲线是M;
(2)当温度是10℃时,乙物质的溶解度是20.9g,所以a=20.9;
(3)当温度是40℃时,甲物质的溶解度是40.0g,将30g甲物质溶于50g水中,只能溶解20g甲物质,所得饱和溶液的质量是70g,溶质质量是20g,故溶质的质量分数![]() ;
;
(4)因为甲物质的溶解度随温度变化较小,乙物质的溶解度随温度变化较大,所以可以采用冷却热饱和溶液的方法,从甲、乙混合溶液中提纯乙;
(5)根据上表数据分析,20℃时,甲物质的溶解度大于乙物质,30℃时,甲物质的溶解度小于乙物质,所以甲、乙两物质溶解度相等温度在20~30℃之间,故选B。

 考前必练系列答案
考前必练系列答案【题目】真真实验小组欲亲自探究适合在实验室制取二氧化碳的药品。她们准备利用碳酸钠粉未、块状大理石、稀盐酸、浓盐酸、稀硫酸五种药品进行实验探究
(提出问题)上述药品间的相互反应都适合在实验室制取二氧化碳气体吗?
(方案设计)(1)经过讨论大家都致认为浓盐酸不适合用于实验室制取二氧化碳你认为原因是___。
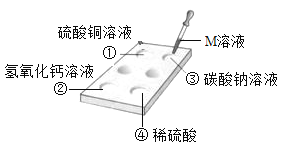
(2)真真小组同学经过反复设计研究后确定迸行如下图所示的四个实验
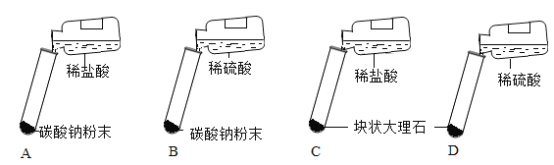
(结论分析)实验报告单如下表
实验编号 | 实验现象 | 实验结论 |
A | 剧烈反应,迅速产生大量气泡 | 反应速率过快,不便于气体收集 |
B | 剧烈反应,迅速产生大量气泡 | _________ |
C | ______ | 便于收集,适合在实验室制取CO2 |
D | 一开始产生气泡,之后便迅速减慢直到反应几乎停止 | 因为无法持续的产生气体,不适合用在实验室制取二氧化碳 |
(3)①结合上面的实验探究报告,可用于实验室制取二氧化碳气体的化学反应方程式为___;
②在确定实验室制取气体反应原理时,要考虑诸多因素,请你再写出一种需要考虑的因素:___;
(继续探究)在实验室里,小组同学利用12.3%的稀盐酸与块状大理石来制取二氧化碳。
(问题引入)(4)实验结束后发现裝置内废液中还有块状固体存在,但已观察不到气泡产生,反应后的废液中还有盐酸吗?甲同学用pH试纸测得该废液的pH=2,证明___;
(5)反应后废液中剩余的块状固体中还有碳酸钙吗?乙同学带着疑问取岀废液中块状的固体,洗净后放入试管中, 再加入约2mL的___, 立即产生大量的气泡, 证明___。
(猜想验证)(6)既然反应后废液中还有盐酸和碳酸钙,那为何观察不到实验现象呢?
①同学认为是废液中盐酸浓度太低,所以观察不到现象。甲同学将少许___置于试管中,加入约2mLpH=1的稀盐酸,立即观察到有气泡冒出
②乙同学认为是实验所用大理石块较大,与盐酸接触不充分,所以观察不到明显的现象,于是乙同学向老师要了一些纯净的碳酸钙粉未放入试管中,加入约2ml___,立即观察到有气泡冒出
(实验结论)
(7)依据(4)(5)确定发生反应后装置废液中的盐酸与碳酸钙共存,但不能观察到现象。结合实验(6)①②闸述其原因___;
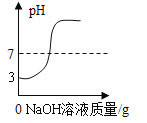
(拓展延伸)(8)实验室用块状大理石与稀盐酸反应 pH至气泡逸出不明显后,测得残留液 pH=2,若取适量残留液体的上层清液于试管中,逐滴滴入碳酸钠溶液至过量。请在下图中绘出变化趋势___。

【题目】下列对化学基本观念的归纳和分析不正确的是( )
A.变化观 | B.守恒观 |
①燃烧是化学变化,爆炸不一定是化学变化 ②有些化学变化没有明显的外在现象 | ①质量守恒的原因是化学反应中原子和分子的种类、质量不变 ②某物质燃烧生成二氧化碳和水,该物质一定含有碳、氢、氧元素 |
C.粒子观 | D.分类观 |
①金刚石、石墨是由原子构成的,C60 是由分子构成的 ②阴离子的质子数小于核外电子数 | ①冰水混合物和干冰都属于纯净物 ②反应 |
A.AB.BC.CD.D
【题目】为测定硫酸铜与硫酸钠的混合溶液中溶质硫酸铜的质量分数,取该溶液100g,再将 120g一定质量分数的氢氧化钠溶液分6次加入到该溶液中,充分反应后,测得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
生成沉淀物的质量/g | 1.96 | 3.92 | 5.88 | 7.84 | 9.8 | 9.8 |
(1)滴加氢氧化钠溶液的过程中的现象是: 。
(2)该混合溶液中溶质硫酸铜的质量分数是多少?
【题目】化学小组的同学们在完成“铁粉与水蒸汽反应”的拓展实验时总是效果不好,于是大家想对这个实验的影响因素作进一步研究,开展了以下研究活动。
(查阅资料)实验中可以用Ca(OH)2固体加热来提供稳定的水蒸汽,反应原理如下:
(1)Ca(OH)2 ![]() H2O↑+ CaO
H2O↑+ CaO
(2)3Fe+4H2O(水蒸汽)![]() Fe3O4+ 4H2↑
Fe3O4+ 4H2↑
(猜想假设)此实验的影响因素有Ca(OH)2的质量、铁粉的质量和反应物的放置方式
(进行实验)同学们组装了如图所示的实验装置(酒精灯外焰约600℃)。
用洗涤灵配制发泡剂,将玻璃导管伸入发泡剂中观察氢气的产生;选定 “氢气泡爆鸣时间”为实验效果指标。“氢气泡爆鸣时间”指的是从开始加热到第一个氢气泡燃着并发出爆鸣声的时间。
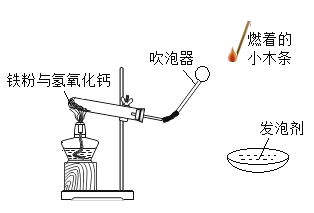
为了排除偶然因素的干扰,共进行了4次平行实验。“氢气泡爆鸣时间”的数据是平行实验数据的平均值。实验数据整理在下表
因素 序号 | 反应物放置方式 | 铁粉的质量/g | Ca(OH)2的质量/g | 实验指标 |
氢气泡爆鸣时间/s | ||||
1 | 铁粉在上层 | 0.5 | 1.5 | 151 |
2 | 铁粉在下层 | 0.5 | 0.5 | 88 |
3 | 混合 | 0.5 | 1.0 | 77 |
4 | 铁粉在上层 | 1.0 | 1.0 | 119 |
5 | 铁粉在下层 | 1.0 | 1.5 | 44 |
6 | 混合 | 1.0 | ? | 58 |
7 | 铁粉在上层 | 1.5 | 0.5 | 66 |
8 | 铁粉在下层 | 1.5 | 1.0 | 54 |
9 | 混合 | 1.5 | 1.5 | 60 |
(解释与结论)
(1)实验中用“点燃观察气泡燃着并发出爆鸣声证明氢气产生”是利用了氢气的_____(填写物质的性质)
(2)实验6中Ca(OH)2的质量应为____g。
(3)通过对以上实验数据分析,发现了最佳实验条件,并采用最佳实验条件又做了验证性实验如下表 ,将下表补全。
反应物放置方式 | 铁粉的质量/g | Ca(OH)2的质量/g | 氢气泡爆鸣时间/s |
________ | _________ | 0.5 | 35 |
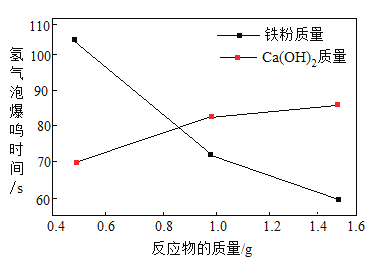
(4)将表1中部分数据转化为曲线图,如图,比较“铁粉的质量”,“Ca(OH)2的质量”两个因素对实验效果影响较大的因素是________________。
(5)通过观察数据发现“铁放置在下面”比“铁粉放置在上面”、“和氢氧化钙混合”实验效果都好,从反应的条件角度试分析其原因_________。