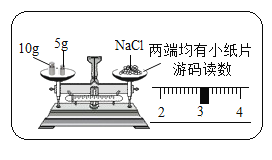
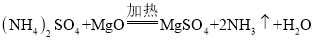��Ŀ����
����Ŀ��ʵ���ҳ������������ķ�ˮ���辭���������ԡ�ij��ȤС��ͬѧ����һ����������������������Һ���������Է�ˮ��
(1)�ⶨ��ˮpH�ķ�����______��
(2)����200 g��������Ϊ5.6%������������Һ
�ټ���:m(KOH)=___g��V(H2O)=______mL(ˮ���ܶȽ���Ϊ1.0gmL-1)
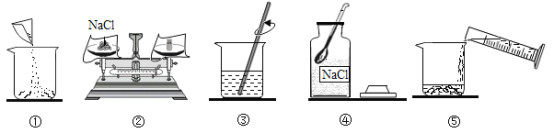
�ڳ�ȡ��������:����������ƽƽ���һֻ�ձ�����������ƽ�����̣�����������.Ȼ��____(�������Ⱥ�˳������ĸ),ֱ����ƽƽ�⡣
A ���ձ��м��������ع���
B ����Ҫ�������롢�ƶ�����
����ȡˮ: ���ܽ�; ��ת�ơ�
(3)�����ⶨ��ˮ:ȡ���Է�ˮ��Ʒ100g,��μ���5.6%������������Һ����ˮ����������������仯��ͼ��ʾ��(�����ˮ�������ɷֲ����������ط�Ӧ)
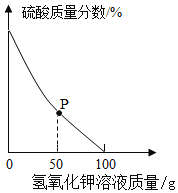
��P���Ӧ��Һ��һ�����ڵ���������_____(�����ӷ���)��
�ڷ�ˮ���������������Ϊ______(���������0.1%).
���𰸡��ø���ྻ�IJ�����պȡ����Һ���ε�pH��ֽ�ϣ�����ɫ�仯�ȶ��������ɫ���Աȣ��ⶨpHֵ 11.2 188.8 BA H+��K+ 4.9%
��������
(1)�ⶨ��ˮpH�ķ����ǣ��ø���ྻ�IJ�����պȡ����Һ���ε�pH��ֽ�ϣ�����ɫ�仯�ȶ��������ɫ���Աȣ��ⶨpHֵ��
(2)����200 g��������Ϊ5.6%������������Һ
�ټ���:m(KOH)=200g��5.6%=11.2g��V(H2O)=![]() =188.8mL��
=188.8mL��
�ڳ�ȡ��������:����������ƽƽ���һֻ�ձ�����������ƽ�����̣�����������.Ȼ����Ҫ�������롢�ƶ����룬�����ձ��м���������ͬ��ֱ����ƽƽ�⡣
��ѡ��BA��
(3)
��P���ʾ���������벿�����ᷴӦ������������Һ�������ỹ��ʣ�࣬��Ӧ��Һ��һ�����ڵ��������У�K����H����
���⣺��ͼ���֪�������������ص�����=100g��5.6%=5.6g��
��μӷ�Ӧ���������Ϊx
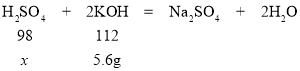
![]()
x=4.9g
��ˮ���������������=![]() ��
��