题目内容
(3分)某碳酸钠样品中含有少量氯化钠。现称量11 g该样品放入烧杯中,然后加入一
定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得
到12.1g氯化钠固体。计算:
(1)碳酸钠样品中碳酸钠的质量
(2)反应后所得溶液中溶质的质量分数。(结果精确到0.1%)
(1)10.6g ;(2) 21.4%
【解析】
试题分析:【解析】
设碳酸钠的质量为x
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑ ………………………(1分)
106 73 117 44

11g - x + 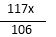 = 12.1 g
= 12.1 g
x = 10.6 g ………………………(1分)

生成二氧化碳的质量为: ×10.6g = 4.4g
同理,生成氯化钠的质量为:11.7g 参加反应的盐酸的质量为: 7.3g
反应后所得溶液中溶质质量分数为: ×100% ≈ 21.4% …(1分)
×100% ≈ 21.4% …(1分)
答:碳酸钠样品中碳酸钠的质量为10.6g , 反应后所得溶液中溶质的质量分数为21.4%
考点:根据化学方程式的计算、有关溶液的计算

(7分)有A~E五种稀溶液,分别是稀盐酸、氢氧化钠溶液、氢氧化钙溶液、酚酞溶
液、碳酸钠溶液、氯化钠溶液中的一种,请根据以下实验现象回答问题。
已知:碳酸钠溶液呈碱性。
(1)将适量A分别滴入盛有少量B、C、D、E的试管中,实验记录如下:
| B | C | D | E |
A | 无明显变化 | 液体变红色 | 无明显变化 | 白色沉淀 |
C中溶液是 ,E中发生反应的化学方程式为 。
(2)再将适量B分别滴加到上述实验后盛有C、D、E的试管中,C中液体由红色变为无
色,D中无明显变化,E中沉淀消失。
①B中溶液是 ,C中发生反应的化学方程式是 。
②盛有E的试管中最终所得溶液中一定含有的溶质是 。
(3)对还没有确定的液体,下列鉴别方法中,正确的是 (填字母序号)。
A.分别滴加适量水 B.分别蒸发溶剂
C.分别滴加无色酚酞溶液 D.分别通入CO2后,再滴加稀盐酸
某品牌矿泉水的标签上的内容如表所示。下列说法中,不正确的是
水质主要成分(mg/L)和酸碱度 |
偏硅酸:25-50 pH:6.5-8.5 锶:0.20-0.50 钾:3.0-4.8 钠:28- 48 钙:15-30 镁:8-18 |
A.该品牌矿泉水为混合物
B.该品牌的矿泉水一定呈酸性
C.“锶、钠、钙、镁、钾”属于金属元素
D.饮用该矿泉水可以为人体补充人体所需的无机盐



