题目内容
(3分)欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
(1)Cu﹣Zn(2)合金中铜的质量分数为60%
【解析】
试题分析:(1)在铜银合金中,两种金属的活动性均在氢的后面。所以都不能和酸发生反应。因此无法测出其中的成分。在铜锌合金中,铜不与酸反应,锌能与酸反应生成氢气。所以可通过测量生成氢气的质量(或固体与酸充分反应后的减少的质量),得知金属锌的质量。进一步求出铜的质量分数。 即现有条件下能测出铜锌合金中铜的质量分数。
(2)已知量:氢气的质量为0.4g;未知量:铜在合金中的质量分数。
解题思路:可根据锌与硫酸反应的化学方程式,利用锌和氢气在反应中的质量关系求解出合金中含锌的质量。进一步求出铜的质量及其中合金中的质量分数。具体解题过程如下:
【解】设合金中Zn的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 2
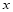 4g
4g
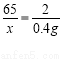
x = 13 g
合金中铜的质量= 32.5g – 13g = 19.5g
合金中铜的质量分数为: 60%
60%
答:合金中铜的质量分数为60%。(其它合理解法均可)
考点:根据化学方程式的计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

