题目内容
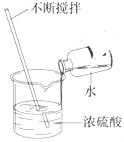
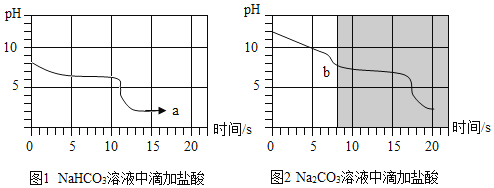
【题目】在20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是( )
A. 图甲溶液中溶质的质量分数a大于b
B. 图丙中M表示b的溶解度曲线
C. 图乙中a、b溶液一定是不饱和溶液
D. 30℃时a、b溶液溶质质量分数不相等
【答案】C
【解析】
A、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后,a中有剩余固体,b中无剩余固体,溶液中溶质的质量分数a应小于b,故A错误;
B、根据图甲中信息可以知道20℃时a的溶解度小于b的溶解度,图丙中在20℃时,N曲线的溶解度大于M曲线的溶解度,故M表示的是a物质的溶解度曲线,故B错误;
C、由题意可知,在20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,b中溶质乙完全溶解,b的溶解度随温度的升高而增大,当升高到50℃,b溶液为不饱和溶液,50℃时,a的溶解度大于b,所以图乙中a、b溶液一定是不饱和溶液,故C正确;
D、根据图丙可知两种物质的溶解度都随温度升高而增大,因此30℃时,a、b的溶解度都比20℃时大,且30℃时两物质的溶解度相等,当a中的物质完全溶解时,溶质的质量分数就会相等,故D错误。故选C。

【题目】实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
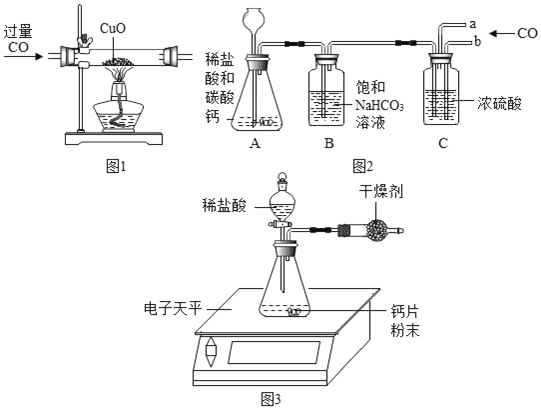
(活动与探究一)收集不同体积比例的二氧化碳和一氧化碳混合气体.
方案一:如图1所示
(1)请写出硬质玻璃管中发生反应的化学方程式_____;
(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是_____;
方案二:根据如图2装置所示请回答下列问题:(提示:饱和NaHCO3溶液的作用是除去HCl气体,部分夹持装置及导管已略去)
(1)写出装置A中发生反应的化学方程式:_____.
(2)CO气体应由_____(填“a”或“b”)通入,在C中混合后,由另一导管导出.
(3)装置C中浓硫酸的两点主要作用:
①干燥气体,减少实验误差;②_____.
测定某钙片(主要成分CaCO3)中碳酸钙的质量分数,用如图3装置进行如下实验:①取研碎后的钙片4克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入过量的稀盐酸,置于电子天平上测出装置总质量.②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量.③整理相关数据如下表
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
(1)小明结合表中数据,计算该钙片中碳酸钙的质量分数.(其它成分不与盐酸反应).
(2)该实验中,如果装置中不加固态干燥剂(干燥剂的作用:吸水但不吸二氧化碳),则最终所算得钙片中碳酸钙的质量将_____(填“偏大”“偏小”或“不变”).