题目内容
【题目】某小组同学利用传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。
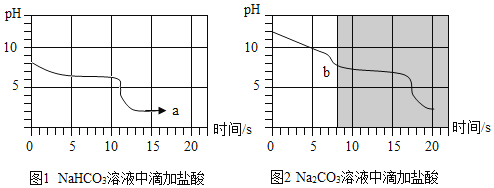
25℃时,向等体积、含有等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,利用pH传感器测得pH变化与时间的关系如图1、图2所示,将图1、图2的阴影部分进行叠加,发现两者基本重合。
回答下列问题:
(1)等体积、含有等碳原子数的碳酸氢钠和碳酸钠溶液均呈碱性,两种溶液中碱性较强的是_____。
(2)a点的溶质为_____,b点前发生反应的化学方程式为_____。
(3)含有等碳原子数的碳酸氢钠和碳酸钠溶液,加入足量的盐酸,产生二氧化碳的质量_____。
A 碳酸氢钠多 B 碳酸钠多 C 两者一样多 D 不能确定哪个多
【答案】碳酸钠(或Na2CO3) NaCl、HCl Na2CO3+HCl=NaCl+NaHCO3 C
【解析】
(1)碱性溶液pH大于7,显碱性溶液pH越高,碱性越强,两种溶液中碱性较强的是碳酸钠(或Na2CO3);
(2)实验中,a点的溶质有碳酸氢钠和盐酸反应生成的氯化钠和过量的盐酸中的氯化氢;b点前,碳酸钠和稀盐酸反应生成氯化钠、碳酸氢钠,发生反应的化学方程式为:Na2CO3+HCl=NaCl+NaHCO3;
(3)由于是向含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别加入足量的盐酸,根据碳原子守恒,最终生成二氧化碳的量相等。

【题目】化学研究小组在开展了“过氧化氢制取氧气的反应中二氧化锰的作用”之后,又进行了“寻找新的催化剂”的探究实验。
(提出问题1)寻找“氧化铁能否用于过氧化氢溶液分解的催化剂”的证据?如果能,它的催化效果如何?(实验设计1)
实 验 | 现 象 |
Ⅰ、分别量取5毫升5%的过氧化氢溶液于A、B两支试管中,向A中加入a克氧化铁粉末,并分别在A、B两支试管中伸入带火星的木条,观察现象, | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
Ⅱ、将“实验Ⅰ”中A试管的剩余物质分离,将所得固体进行洗涤、干燥、称量 | 所得固体质量为 ______ 克 |
Ⅲ、将“实验Ⅱ” ______ | ______ |
Ⅳ、分别量取5毫升5%的过氧化氢溶液放入C、D两支试管中,向C试管中加入a克氧化铁粉末,向D试管中加入a克二氧化锰粉末 |
(实验结论)
(1)A中产生的气体是______;
(2)氧化铁可以作过氧化氢分解的催化剂,寻找该结论的证据主要是设计了实验______(选填Ⅰ、Ⅱ、Ⅲ或Ⅳ)展开的。
(实验评价)
(1)设计实验Ⅲ的目的是______;
(2)可以用下列方法作出判断,从而达到实验Ⅳ的设计目的。a、定性判断:观察C、D两支试管中产生气泡的快慢;b、定量判断:______。
(资料信息)过氧化氢分解除了用二氧化锰还可用氧化铜等物质作为催化剂
(提出问题2)氧化铜(黑色粉末)是否也能作氯酸钾分解的催化剂?它是否比二氧化锰效果更好?
(设计实验2)某同学以生成等体积的氧气为标准,设计了下列三组实验
(其它可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2克 | X | |
② | 1.2克 | 氧化铜0.5克 | Y |
③ | m | 二氧化锰0.5克 | Z |
(1)写出氯酸钾在二氧化锰的催化作用下发生的反应的化学方程式:______。
(2)上述实验应测量的“待测数据”是指______,从数学描述角度,X、Y、Z在数值上的大小关系是______。
(3)若实验②比实验①的“待测数据”更______(填“大”、“小”、“不确定”),说明氧化铜能加快氧酸钾的分解速率,表中“m”的数值应该为______。
(4)将实验②反应后的固体经过过滤、洗涤、干燥处理后,称量得到0.5克黑色粉末,再将黑色粉末放入______(简述操作)。
(评价设计)
(5)你认为该小组同学设计实验③和实验②对比的目的是______。