题目内容
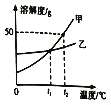
【题目】水是常用的溶剂。如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。

(1)t1℃时,将4.0 g甲物质放入10 g水中充分溶解得到________g溶液。
(2)若固体乙中混有少量固体甲,则提纯乙的方法是:溶解、_________、过滤。
(3)将t2℃时丙的饱和溶液降温到t1 ℃时,丙溶液溶质质量分数_________(填“变大”“变小”或“不变”)。
【答案】12 蒸发结晶 不变
【解析】
(1)t1℃时,甲物质的溶解度为20g,即该温度下,100g水中最多能溶解20g甲物质,则10g水中最多能溶解2g甲物质,故t1℃时,将4.0 g甲物质放入10 g水中充分溶解得到12g溶液;
(2)由图可知,甲、乙的溶解度都随温度的升高而增加,甲的溶解度受温度的影响较大,乙的溶解度受温度的影响较小,故若固体乙中混有少量固体甲,可采用蒸发结晶的方法提纯乙,故提纯乙的方法是:溶解、蒸发结晶、过滤;
(3)由图可知,丙的溶解度随温度的升高而减小,故将t2℃时丙的饱和溶液降温到t1 ℃时,丙变为不饱和溶液,故降温后,丙溶液溶质质量分数不变。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】实验室有一瓶没有密封好的氢氧化钠固体,为了验证其是否变质,同学们对这瓶固体成分进行了下列实验探究。
(查阅资料)Na2CO3溶液呈碱性,CaCl2溶液呈中性
(提出猜想)
猜想Ⅰ:固体全部是NaOH;
猜想Ⅱ:固体全部是______________;
猜想Ⅲ:固体是NaOH和Na2CO3的混合物。
(进行实验):
实验操作步骤 | 实验现象 | 结论及化学方程式 |
步骤1:取少量固体于试管中,加水溶解,滴入足量稀盐酸 | ______________ | 猜想Ⅰ不成立。 |
步骤2:另取少量固体于试管中,加水充分溶解,再滴加过量氯化钙溶液 | ______________ | 猜想Ⅱ或Ⅲ成立。 反应的化学方程式为: _______________________________ |
步骤3:取步骤2反应后的上层清液于试管中,滴入无色酚酞试液 | 若酚酞不变红色 | 猜想________成立 |
若酚酞变红色 | 猜想________成立 |
(问题讨论)步骤2中滴加氯化钙溶液必须“过量”的原因是________________。
(反思与交流)久置的固体氢氧化钠变质的原因是(用化学方程式表示)______________。