题目内容
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示.则有关说法中不正确的( )

A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为8: 1
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
【答案】C
【解析】化学反应遵守质量守恒定律,反应后质量增多的物质是生成物,减少的物质是反应物。据图可知,甲是生成物,丁是反应物,丙是生成物,乙质量不变,可能作催化剂。即该反应是丁=丙+甲。A.丁发生分解反应,故丁一定是化合物,正确;B.乙可能是这个反应的催化剂,正确;C.生成的甲、丙两物质的质量比为(19%-17%):(41%-25%)=8: 16=1:2,错误;D.根据质量守恒定律,参加反应的丁的质量一定等于生成甲和丙的质量之和,正确。故选C。

 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】在化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂,为了确定其成分,同学们进行了如下的探究活动:
【查阅资料】
Ⅰ.石灰干燥剂的有效成分为生石灰(CaO)
Ⅱ.Ca(OH)2是一种微溶于水的白色固体,其水溶液(俗称石灰水)具有如下性质:能使无色酚酞(一种化学指示剂)溶液变红,与CO2气体反应出现浑浊,能与盐酸反应但无明显现象。
【方案设计】
小组成员设计了如下实验方案以期得到相应推论:取样滴加稀盐酸,有气泡产生,则白色固体为CaCO3;若无气泡产生,则白色固体为Ca(OH)2
(1)请简要说明上述方案中不合理之处:___________。
(2)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你设计一种实验方案予以证明。
实验步骤 | 实验现象 | 结论 |
______________ | _____________ | 含CaCO3 |
______________ | _____________ | 含Ca(OH)2 |
【数据分析】
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学向10克样品中加入足量的稀盐酸,测得CO2气体的质量如图所示。
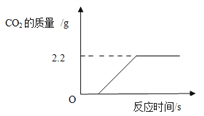
(3)根据题给信息猜想一下,实验开始时的一段时间没有CO2气体产生的原因是_______;计算该混合物中CaCO3的质量分数_____________(请写出过程)。
【反思与评价】
实验中,如有部分二氧化碳气体因溶解于水而没有全部逸出,则测得的混合物中CaCO3的质量分数________(填写“偏大”、 “偏小”或“不变”)。
【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A.氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B.在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C.从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D.分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
