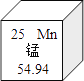
题目内容
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
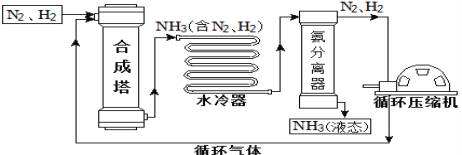
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的化学方程式是:________
(2)生产过程中可重复使用的物质是_______________(填化学式)。
(3)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在_________℃。
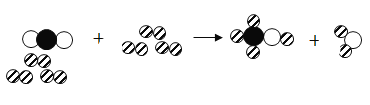
(4)下图是合成塔中发生反应的微观粒子示意图:
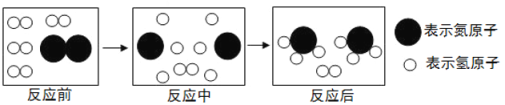
由图可知两种反应物N2与H2的分子个数比为____________;该反应中的最小粒子是_________(填写化学符号)。
【答案】N2+3H2 2NH3 N2、H2 -33.35 1:3 N和H
2NH3 N2、H2 -33.35 1:3 N和H
【解析】
(1)氮气和氢气在高温、高压、催化剂条件下生成氨气,反应的化学方程式为N2+3H2 2NH3;
2NH3;
(2)由合成氨工艺的主要流程图可知,氮气和氢气可重复使用,化学式分别为N2、H2;
(3)由表可知,氨气的沸点高于氮气和氢气的沸点,故在1.01×105 Pa时,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在-33.35℃;
(4)由图可知两种反应物N2与H2的分子个数比为1:3;该反应中的最小粒子是氮原子和氢原子,化学符号分别为N、H。

【题目】同学们可以通过下列方式认识空气。
(组成角度)
在氮气、氧气、氦气、二氧化碳、二氧化硫气体中。用化学用语填写:
不是空气的组成成分会引起酸雨的气体是__;可用于代替氢气填充气球的是_____;人类时刻都离不开空气,是因为有_____; 会引起温室效应的气体是_____, 写出实验室检验该气体的化学方程式_________
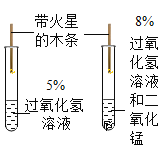
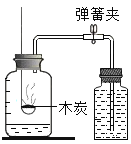
②为测定空气中氧气体积分数,设计如图实验。
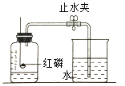
I.该实验中红磷需要过量的原因是__________;
II.红磷燃烧的现象是_________,反应的化学方程式_____________;
III.冷却至室温后打开止水夹观察到的现象是_______;
某同学用该装置做测定空气中氧气体积分数实验时,其它操作步骤都正确,但止水夹没夹紧,则所测定的氧气体积分数结果 ____(填 偏大或偏小或不影响)
(微观角度 )![]()
①用“化学符号”或“图示”填空。
图 示 |
| ______ |
|
化学符号 | ___ | N2 | _____ |
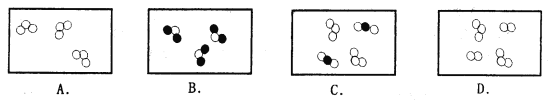
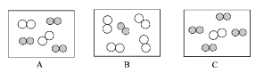
②同温同压下,气体的体积比等于分子个数比。若忽略空气中其它成分,如图可表示空气微观模型的是________(填选项)。
(变化角度)
在一个标准大气压下,空气中部分组分的沸点如下:
组分 | 氮气 | 氧气 | 二氧化碳 |
沸点(℃) | -195.8 | -183.0 | -78.4 |
燃着的木条置于盛有液态空气(-200℃)的钢瓶口,观察到的现象是____。
②下列叙述错误的是_____。
A.食品包装内充N2以防腐,因为N2的化学性质比较稳定;
B.工业上分离液态空气制取氧气是化学变化
C.从冰箱里拿出汽水,瓶子外表有液珠,说明空气中有水蒸气
D.久置澄清石灰水的试剂瓶内壁有一层白膜,证明空气中有二氧化碳