题目内容
【题目】某实验室为了测定石灰石样品中碳酸钙的含量,进行如下实验:
步骤 1:称取 40g 石灰石样品(假设杂质耐高温且不与酸反应),高温煅烧一段时间,恢复到室温,测得固体质量减少了11g。
步骤 2:向剩余固体中加入足量的稀盐酸至不再反应为止,生成气体的质量与时间的关系如下表:
时间 | t0 | t1 | t2 | t3 | t4 | t5 | t6 | t7 |
气体/g | 0 | 1.5 | 2.8 | 3.7 | 4.2 | 4.3 | 4.4 | 4.4 |
(1)步骤1中生成二氧化碳的质量为_____g。
(2)求步骤1中生成的氧化钙的质量_____(写出计算过程)。
(3)根据步骤2数据画出生成气体的质量与时间的关系_____。

(4)样品中碳酸钙的质量分数_____。(保留到 0.1%)
【答案】11 14g 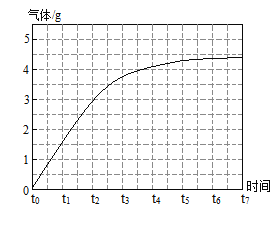 87.5%
87.5%
【解析】
(1)碳酸钙高温分解生成氧化钙和二氧化碳,高温煅烧一段时间,恢复到室温,测得固体质量减少了11g,步骤1中生成二氧化碳的质量=11g;
(2)设步骤 1 中生成的氧化钙的质量为x。
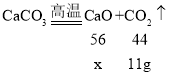
![]()
x=14g,即步骤1中生成的氧化钙的质量为14g;
根据质量守恒定律可知,参加反应的碳酸钙质量=14g+11g=25g;
(3)根据步骤 2 数据可知,二氧化碳的质量从0开始,逐渐增大,反应速率逐渐减小,时间到t6时,达到最大值4.4g,生成气体的质量与时间的关系如图: 。
。
(4)设生成4.4g二氧化碳需碳酸钙质量为y。
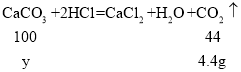
![]()
y=10g
样品中碳酸钙的质量=25g+10g=35g;
样品中碳酸钙的质量分数=![]() 。
。

练习册系列答案
相关题目