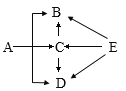
题目内容
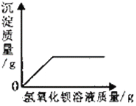
【题目】如图所示,下列判断正确的是

A. Y 的溶解度比X 的溶解度大
B. t1℃时,X、Y 两种饱和溶液的溶质质量分数都是 20%
C. 若烧杯内有晶体析出,则烧杯中饱和溶液的溶质为 Y
D. t2℃时,若X、Y 的饱和溶液质量相等,则溶液中溶质的质量X<Y
【答案】D
【解析】
A、由溶解度曲线可知,0- t1℃,X的溶解度比Y的溶解度大,t1℃时,X的溶解度与Y的溶解度相等,而t1℃- t2℃,Y的溶解度比X的溶解度大,故不符合题意;
B、t1℃时,X、Y 两种饱和溶液的溶质质量分数都是 ![]() ×100%=16.7%,故不符合题意;
×100%=16.7%,故不符合题意;
C、氢氧化钠固体溶于水放热,由溶解度曲线可知,X随温度的升高,溶解度减小,若烧杯内有晶体析出,则烧杯中饱和溶液的溶质为X,故不符合题意;
D、由溶解度曲线可知,t2℃时,Y 的溶解度大于X,若X、Y 的饱和溶液质量相等,则溶液中溶质的质量X<Y,故符合题意。

【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为_____。
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_____(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为_____,据此可知金属活动性Al比Cu_____(填“强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是_____。
(猜测与探究)
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象 | 结论 | 推论 |
(1)向一支试管中再加入 NaCl固体 | 铝丝表面析 出红色固体 | 氧化铝薄膜 被破坏 | Na+或①_____能 破坏氧化铝薄膜 |
(2)向另一支试管中再加入 Na2SO4固体 | ②_____ | 氧化铝薄膜 未被破坏 | Na+和SO42都不能 破坏氧化铝薄膜 |
(结论与反思)
得出结论:前述猜测_____(填“正确”或“不正确”)。总结反思:本次探究充分运用了比较法和控制变量法。