��Ŀ����
����Ŀ����10�֣������װ�г�ʹ��һ�ִ�װ��������Ʒ��Ϊ��504˫�����������ǩ��ͼ��ʾ��ͬѧ�Ƕ�һ�����õġ�504˫������������Ʒ�ܺ��棬���ʵ�����̽����

��������⡿���ù���ijɷ���ʲô��
���������ϡ������Ȼ�����Һ�ڳ����·�����Ӧ�����Ȼ�������
���������롿���ù����п��ܺ���Fe��Fe2O3��CaO��Ca(OH)2��CaCO3��
���ù��������ܺ���Ca(OH)2��ԭ����(�û�ѧ����ʽ��ʾ) ��
��ʵ��̽��1��
��ͬѧ�ķ�����
ʵ����� | ʵ������ | ʵ����� |
��1��ȡ������������Թ��У�����������ˮ�ܽ⣬���ú�ȡ�ϲ���Һ�μ���ɫ��̪��Һ�� | �����ܽ�ʱ�Թ���ڷ��̣��Թܵײ��в������Һ��졣 | ������һ������ ���������ơ� |
��2����ȡ������������Թ��У��μ�����ϡ���ᡣ | ��������ʧ���д�����ɫ����������õ�dz��ɫ��Һ�� | ������һ������ �� һ������Fe2O3�� |
��3����������2���в���������ͨ�뵽�����ʯ��ˮ�С� | ������һ������CaCO3�� |
��ʵ�����ɡ�
��1����ͬѧ��Ϊ��ͬѧ��ʵ���в����ܵó�һ����Ca(OH)2�Ľ��ۣ������� ��
��2����ͬѧ��Ϊ��ͬѧ��ʵ�鲢���ܵó�һ������Fe2O3�Ľ��ۣ�������(�û�ѧ����ʽ��ʾ) �� ��
��ʵ��̽��2��
�ҡ���ͬѧ�������ʵ�鷽��������֤��
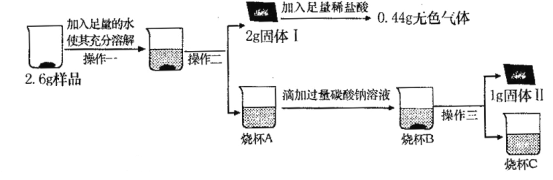
��1���ҡ���ͬѧʵ�������ܵó�������Ʒ��һ�������� ��
��2����ͬѧ����ʵ������������C��CaCO3 ��������Ϊ1.0 g��������ҺA�к��������Ƶ���������д��������̣�
��3����ͬѧ����ʵ�����������������к������ʵ�������Ϊ1.6 g������B��CaCO3������Ϊ1.0 g��
��ʵ����ۡ��ۺ�����ʵ���Լ��ҡ�����λͬѧ��ʵ�����ݣ��õ������ù���ijɷ���
���𰸡����������롿CaO+H2O =Ca(OH)2
��ʵ��̽��1��
ʵ����� | ʵ������ | ʵ����� |
��1�� | ������һ������ CaO ���������ơ� | |
��2�� | ������һ������Fe �� һ������Fe2O3�� | |
��3�� | ����ʯ��ˮ����� |
��ʵ�����ɡ���1��CaO��ˮ��Ӧ���ɵ�Ca(OH)2Ҳ��ʹ��ɫ��̪��죬����ȷ��ԭ�������Ƿ���Ca(OH)2
��2��Fe2O3+ 6HCl = 2FeCl3 + 3H2O Fe + 2FeCl3 = 3FeCl2
��ʵ��̽��2����1��Fe2O3 ��2��0.74g
��������
������������������롿���ù��������ܺ���Ca(OH)2��ԭ���������ƻ�������е�ˮ��Ӧ���û�ѧ����ʽ��ʾ��CaO+H2O =Ca(OH)2
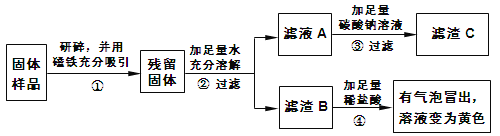
��ʵ��̽��1����1��ͨ������������ˮ�������ܽ�ʱ�Թ���ڷ��̣�˵��һ�����������ƣ���Ϊ��������ˮ������Ӧ��ų���������
��2����ȡ������������Թ��У��μ�����ϡ���������������ж��д�����ɫ����������õ�dz��ɫ��Һ��������һ������Fe
��3����������2���в���������ͨ�뵽�����ʯ��ˮ��������ʵ�������������һ������CaCO3����ʵ������Ϊ������ʯ��ˮ�����
��ʵ�����ɡ���1����ͬѧ��Ϊ��ͬѧ��ʵ���в����ܵó�һ����Ca(OH)2�Ľ��ۣ�������CaO��ˮ��Ӧ���ɵ�Ca(OH)2Ҳ��ʹ��ɫ��̪��죬����ȷ��ԭ�������Ƿ���Ca(OH)2
��2����ͬѧ��Ϊ��ͬѧ��ʵ�鲢���ܵó�һ������Fe2O3�Ľ��ۣ������������ܺ����������������ᷴӦ����FeCl3��Ȼ��Fe����FeCl3��Ӧ����FeCl2����Ȼ���Եõ�dz��ɫ��Һ���û�ѧ����ʽ����ʾΪ��Fe2O3 + 6HCl = 2FeCl3 + 3H2O ��Fe + 2FeCl3 = 3FeCl2
��ʵ��̽��2����1�������ҡ���ͬѧʵ�������ֵ�����������B�м������������ᣬ��Һ��Ϊ��ɫ�������ܵó�������Ʒ��һ��������Fe2O3
��2������ҺA�м���̼������Һ����������C�������Ļ�ѧ����ʽΪ��Ca(OH)2+Na2CO3==CaCO3��+2NaOH ���ʿɸ��ݷ���ʽ��CaCO3��Ca(OH)2��������ϵ�����������ҺA�к��������Ƶ�����
�⣺����ҺA�к��������Ƶ�����Ϊx
Ca(OH)2+Na2CO3==CaCO3��+2NaOH
74 100
x 1.0g
74��100=x:1.0g
x=0.74g