题目内容
【题目】根据下列实验装置图,回答问题:
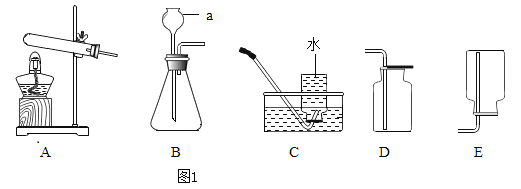
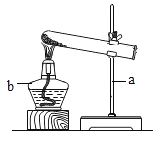
(1)写出图中仪器a的名称:____________________________。
(2)实验室制取并收集二氧化碳,应选用的装置是____________________________(填字母),发生反应的化学方程式为____________________________。
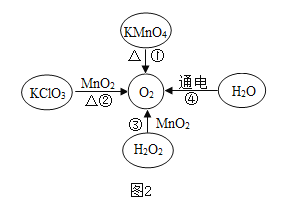
(3)图2的转化②是实验室制取O2的方法之一,用该方法制取并收集氧气,应选用的装置是____________________________(填字母,从A~E中选择),发生反应的化学方程式为____________________________,四种制取氧气的方法中最节能的途径是____________________________,(填序号),水通电分解反应的化学方程式为____________________________。
【答案】长颈漏斗 BD ![]() AC (或AD)
AC (或AD) 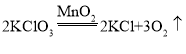 ③
③ 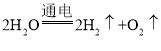
【解析】
(1)仪器a是长颈漏斗。
(2)实验室常用石灰石(或大理石)和稀盐酸反应制取二氧化碳,故发生装置应选用固液常温型的B装置,因为二氧化碳能溶于水且与水反应,密度比空气大,因此只能用向上排空气法收集二氧化碳,收集装置应选D装置收集,故装置应选BD;
石灰石(或大理石)的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,其反应的化学方程式为:![]() ;
;
(3)转化②是加热氯酸钾和二氧化锰的混合物制取氧气,发生装置选用固体加热型的A装置,氧气不易溶于水且密度大于空气,所以既可以用排水法收集,也可以用向上排空气法收集,故收集装置应选C或D,故装置应选AC或AD;
反应的化学方程式为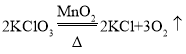 ;
;
四种制取氧气的方法中最节能的途径是③,无需加热,操作简单;
水通电分解为氢气和氧气,反应的化学方程式为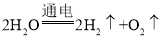 。
。

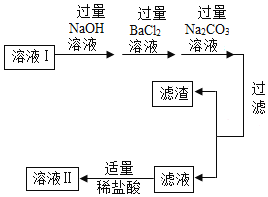
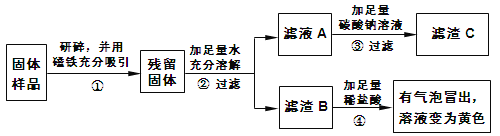
【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。
【题目】在研究酸和碱的化学性质时,同学们想证明:稀H2SO4与NaOH溶液确实发生了反应。请你与他们一起完成实验方案设计、实施和评价。(注:硫酸钠溶液呈中性)
(1)向NaOH溶液中滴入2~3滴酚酞溶液,溶液由无色变为__________色。
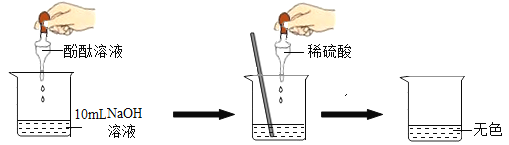
(2)根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为____________。
(3)因为溶液变成了无色,小林说“稀硫酸一定过量了”,小林这么说的理由是_____________。
(4)为确定小林的说法是否正确,同学们又设计了下列实验方案并进行实验:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二一 | 取样,滴入2-3滴紫色石蕊溶液 | 溶液变成红色 | 稀H2SO4过量 |
上述方案中,你认为正确的是____________(填“方案一”或“方案二”)。另外一个实验方案错误的原因(用化学方程式表示): ______________。请你再设计一种实验方案确定稀H2SO4过量,你选用___________(填药品)。