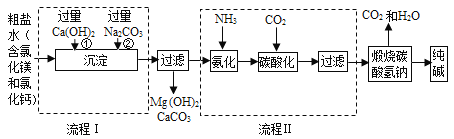
题目内容
【题目】把一块表面锈蚀的铁片放入足量的稀盐酸中,首先观察到的现象是_____,该反应的化学方程式为_____,反应一段时间后,可观察到有气泡产生,则该反应的化学方程式为_____。
【答案】铁锈消失,溶液由无色变成黄色 Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑
【解析】
铁锈的主要成分是![]() ,把一块表面锈蚀的铁片放入足量的稀盐酸中,首先观察到的现象是铁锈消失,溶液由无色变成黄色,该反应是稀盐酸和氧化铁发生反应,生成氯化铁和水,其反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,反应一段时间后,铁锈被全部反应,稀盐酸与铁片继续反应,可观察到有气泡产生,则该反应的化学方程式为Fe+2HCl=FeCl2+H2↑。
,把一块表面锈蚀的铁片放入足量的稀盐酸中,首先观察到的现象是铁锈消失,溶液由无色变成黄色,该反应是稀盐酸和氧化铁发生反应,生成氯化铁和水,其反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,反应一段时间后,铁锈被全部反应,稀盐酸与铁片继续反应,可观察到有气泡产生,则该反应的化学方程式为Fe+2HCl=FeCl2+H2↑。
故填:铁锈消失,溶液由无色变成黄色,Fe2O3+6HCl=2FeCl3+3H2O,Fe+2HCl=FeCl2+H2↑。

练习册系列答案
相关题目
【题目】某同学为测定黄铜屑(由锌和铜形成的合金)样品组。分四次取样品与稀盐酸反应,其实验数据记录见下表。
1 | 2 | 3 | 4 | |
取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
试计算:
①第几次实验金属锌完全反应________。
②所用稀硫酸中溶质的质量分数_______?