题目内容
【题目】回顾实验室制取![]() 的实验,我们可知:研究实验室制取气体的一般顺序:
的实验,我们可知:研究实验室制取气体的一般顺序:
(1)首先研究生成该气体的化学反应原理;
(2)然后根据反应物的状态和反应的条件选择并安装实验仪器,而且一定要检查________;
(3)根据收集气体的________和________确定气体的收集方法;
(4)图中是制氧气的两套装置,按要求回答:
①加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为________;制得氧气后,剩余固体是氯化钾(易溶于水)和二氧化锰(难溶于水)的混合物,将它们分离后可回收使用.分离时,先将混合物放在烧杯中,加适量________并________;将所得的悬浊液进行________,可得到________;将滤液进行________,可得到________.
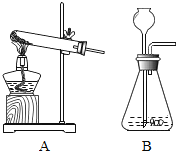
②实验室用过氧化氢和二氧化锰制氧气可选________(图A或B),原因________.
③某兴趣小组取![]() 克过氧化氢溶液在
克过氧化氢溶液在![]() 克二氧化锰的作用下反应,反应一段时间后测得容器中剩余物质的总质量为
克二氧化锰的作用下反应,反应一段时间后测得容器中剩余物质的总质量为![]() 克.试计算:
克.试计算:
(A)该实验中生成氧气的质量为________克,物质的量________摩尔.
(B)根据化学方程式列式计算参加反应的过氧化氢的物质的量____________.
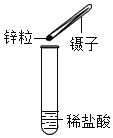
④硫化氢![]() 是一种具有臭鸡蛋气味的气体,其密度比空气的密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁
是一种具有臭鸡蛋气味的气体,其密度比空气的密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁![]() 和稀硫酸
和稀硫酸![]() 混合,在常温下发生反应生成硫酸亚铁和硫化氢气体.试回答:
混合,在常温下发生反应生成硫酸亚铁和硫化氢气体.试回答:
(A)实验室制取硫化氢的化学反应方程式为:________.
(B)制取硫化氢气体的发生装置可以选用________(图A或B);
(C)收集硫化氢气体可用________法.
【答案】装置的气密性 密度 溶解性 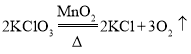 水 搅拌 过滤 二氧化锰 蒸发 氯化钾
水 搅拌 过滤 二氧化锰 蒸发 氯化钾 ![]() 反应物是液体和固体,不需要加热 3.2 0.1 0.2mol
反应物是液体和固体,不需要加热 3.2 0.1 0.2mol
解:设过氧化氢物质的量为x。
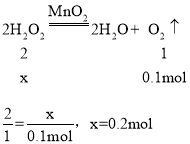
过氧化氢物质的量为:0.2mol。 ![]() B 向上排空气
B 向上排空气
【解析】
(2)根据反应物的状态和反应的条件选择并安装实验仪器,而且一定要检查装置的气密性,故填:气密性。
(3)根据收集气体的密度和水溶性确定气体的收集方法,故填:密度;溶解性。
(4)①加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为: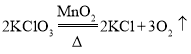 ,氯化钾(易溶于水)和二氧化锰(难溶于水)的混合物,将它们分离后可回收使用,分离时,先将混合物放在烧杯中,加适量水并搅拌;将所得的悬浊液进行过滤,可得到二氧化锰;将滤液进行蒸发,可得到氯化钾,
,氯化钾(易溶于水)和二氧化锰(难溶于水)的混合物,将它们分离后可回收使用,分离时,先将混合物放在烧杯中,加适量水并搅拌;将所得的悬浊液进行过滤,可得到二氧化锰;将滤液进行蒸发,可得到氯化钾,
故填: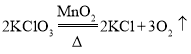 ;水;搅拌;过滤;二氧化锰;蒸发;氯化钾。
;水;搅拌;过滤;二氧化锰;蒸发;氯化钾。
②实验室用过氧化氢和二氧化锰制氧气发生装置可选B,原因过氧化氢制氧气反应物是液体和固体,不需要加热,故填:B;反应物是液体和固体,不需要加热。
③(A)该实验中生成氧气的质量为120g+3g-119.8g=3.2克,物质的量![]() ,故填:3.2g;0.1。
,故填:3.2g;0.1。
(B)设过氧化氢物质的量为x。
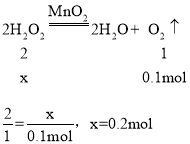
过氧化氢物质的量为:0.2mol。
④实验室用硫化亚铁和稀硫酸制取硫化氢气体,化学反应方程式为![]() ,该反应不需要加热,制取硫化氢气体的发生装置可以选用B,硫化氢密度比空气的密度大,且能溶于水,收集硫化氢气体可用向上排空气法收集,故填:
,该反应不需要加热,制取硫化氢气体的发生装置可以选用B,硫化氢密度比空气的密度大,且能溶于水,收集硫化氢气体可用向上排空气法收集,故填:![]() ;B;向上排空气。
;B;向上排空气。

【题目】为防控新型冠状病毒感染的肺炎疫情,小明家购入了3%过氧化氢消毒液和84消毒液[主要成分(NaClO)],小明将两种消毒液混合后,观察到产生大量气泡,为此小明进行了初步探究。
[资料]NaClO遇水和二氧化碳,反应生成碳酸氢钠和HClO,HClO有刺激性气味,是一种酸,酸性很弱,易分解生成盐酸和氧气。
探究一、探究两种消毒液混合产生的气体成分。
[设计与实验]
操作 | 现象 | 结论 |
取“84”消毒液稀溶液于试管中,滴加3%的过氧化氢溶液,___ | 产生大量无色气体,__ | 产生的气体是氧气 |
探究二、两种消毒液混合时,NaClO是反应物还是催化剂?
[实验设计]如下图所示实验装置,将注射器中30mL3%的过氧化氢溶液平均分6次注入锥形瓶中。
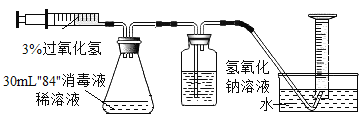
(1)检查装置气密性的方法:将导管的一端放入水中,将注射器的栓塞缓慢向外拉动至某一刻度,观察到水进入导管,则装置气密性良好。
(2)再次注入过氧化氢溶液后,待不再产生气泡,记录收集的气体体积(如下表)。(忽略其他有关因素对测量结果造成的影响)
[数据记录]
实验编号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
量筒内气体总体积/mL | 103 | 206 | 257 | 262 | 267 | X |
[数据分析]表中的数据X=______。
[实验结论]通过分析表中的数据,根据_____,可推知NaClO是反应物。经进一步证明,NaClO与过氧化氢反应后的溶液为氯化钠溶液,请写出NaClO与过氧化氢反应的化学方程式:_______。
[拓展]生活中常用到洗涤剂、消毒剂、染发剂、防腐剂等化学品,使用前需仔细阅读说明书,不能轻易将它们混合使用,否则会因发生反应影响使用效果甚至产生有毒物质,影响健康。
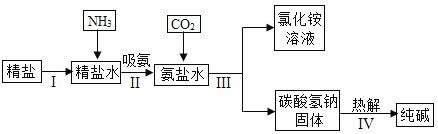
【题目】KNO3 和 KCl 在不同温度时的溶解度如表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
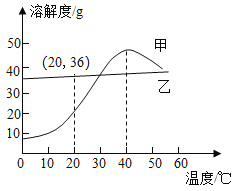
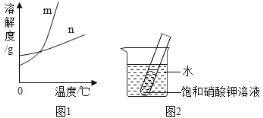
(1)依据上表数据,绘制 KNO3 和 KCl 的溶解度曲线,如图 1 中能表示 KNO3 溶解度曲线的是_____(填 m 或 n)。
(2)20 ℃时,向 10 g 水中加入 2.5 g KNO3 充分搅拌得到 X,再加入 2.5 g KNO3 充分搅拌得到 Y,继续升温至 50 ℃得到 Z,则 X、Y、Z 中为饱和溶液的是_____。
(3)40 ℃时,100 g 水中的硝酸钾饱和溶液稀释成溶质质量分数为10%的溶液,应加水的质量为_____。
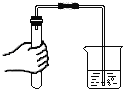
(4)如图 2 所示,20 ℃时,将盛有饱和 KNO3 溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的_____(填字母序号)。
A. 硝酸铵固体 B. 生石灰固体 C. 冰块
(5)将40℃时硝酸钾和氯化钾的饱和溶液,降温至10
A. KNO3溶液析出晶体的质量比KCl析出晶体的质量大
B. 在20℃和30℃之间某一温度,两种溶液的质量分数相等
C. 两种溶液的溶剂质量不变
D. 若继续对两溶液降温,则两溶液将会继续析出晶体,且水溶液会成为纯净物