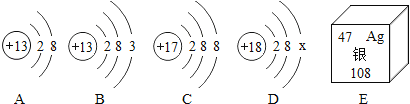
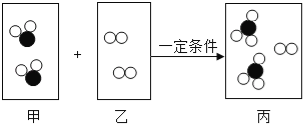
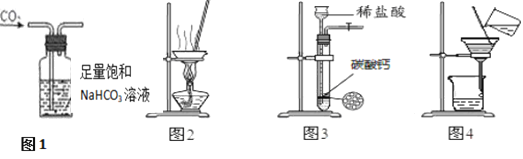
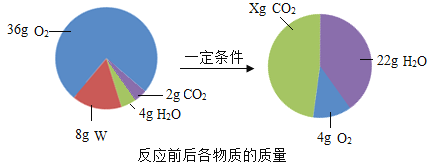
题目内容
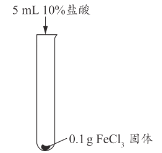
【题目】兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
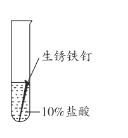
(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
(1)用盐酸除铁锈的化学方程式为_________。
(2)实验1-1的目的是_________。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是_________。
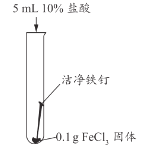
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 | 所用试剂 | 实验现象 | |
反应开始时 | 24h后 | ||
2-1 | 铁锈和2%盐酸 | 铁锈、溶液均无明显变化 | 铁锈消失,溶液变黄色 |
2-2 | 生锈铁钉和2%盐酸 | 生锈铁钉、溶液均无明显变化 | 铁锈消失,溶液变浅绿色 |
23 | 生锈铁钉和6%盐酸 | 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 | 溶液变为浅绿色 |
2-4 | 生锈铁钉和10%盐酸 | 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 | 溶液变为浅绿色 |
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与________有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为______。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
【答案】![]() 探究FeCl3是否会与盐酸反应 酸性条件下,FeCl3与Fe发生反应生成浅绿色的FeCl2 盐酸浓度和反应时间 盐酸浓度低,产生的少量FeCl3在酸性条件下与Fe反应被消耗 BC
探究FeCl3是否会与盐酸反应 酸性条件下,FeCl3与Fe发生反应生成浅绿色的FeCl2 盐酸浓度和反应时间 盐酸浓度低,产生的少量FeCl3在酸性条件下与Fe反应被消耗 BC
【解析】
铁锈的主要成分是氧化铁,盐酸和氧化铁反应生成氯化铁和水,氯化铁和铁反应生成氯化亚铁。
(1)铁锈的主要成分是氧化铁,盐酸和氧化铁反应生成氯化铁和水,故用盐酸除铁锈的化学方程式为![]() 。
。
(2)实验1-1长时间放置,溶液颜色始终为黄色,故目的是探究FeCl3是否会与盐酸反应。
(3)氯化铁和铁反应生成氯化亚铁,故溶液从黄色变浅绿色。
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与盐酸浓度和反应时间有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为盐酸浓度低,产生的少量FeCl3在酸性条件下与Fe反应被消耗。
(6)A、除铁锈时,所用盐酸的浓度越大越好,浓度大会损坏铁制品,故A不正确;
B、在除锈过程中,生成的FeCl3和铁反应生成氯化亚铁,则对铁也有腐蚀作用,故B正确;
C、用盐酸除锈时,应注意控制反应的时间,故C正确。故选BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】依据下列实验和数据回答下列小题。
向100 g水中加入固体A或改变温度,得到相应的溶液①~③。
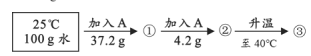
资料:A的溶解度 | |||
温度/℃ | 20 | 30 | 40 |
溶解度/g | 37.2 | 41.4 | 45.8 |
【1】在通常情况下,下列溶液中一般得不到饱和溶液的是
A. 硝酸钾溶液B. 二氧化碳溶液C. 酒精溶液D. 氯化钠溶液
【2】下列说法中,正确的是
A. 配制溶液时,搅拌可以增大固体溶质的溶解度
B. 金属与酸溶液发生置换反应后,溶液质量一定增加
C. 不饱和溶液变为饱和溶液,溶质质量分数一定变大
D. 有单质和化合物生成的反应一定是置换反应