题目内容
【题目】某化学兴趣小组进行如下系列实验。
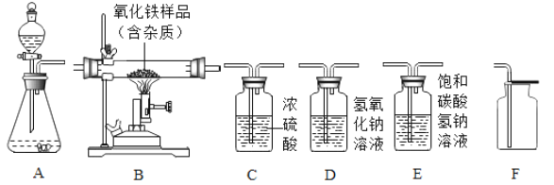
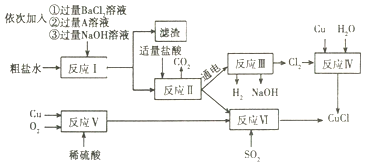
(实验Ⅰ)请根据如图回答问题:
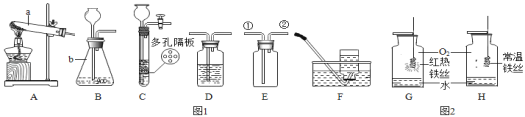
(1)写出图中标有字母的仪器的名称:b_____。
(2)写出实验室用A装置取氧气的化学方程式_________,制得的氧气用来做如图2所示的实验,发现H中铁丝不燃烧,其原因是_________。
(3)实验室制取二氧化碳气体,为了能控制反应的发生与停止,可选用发生装置 ______
(4)若依次连接装置B→D→E收集一瓶干燥的氢气,则应在装置D中盛放_______(填物质名称)试剂,气体应从E装置____(填“①”或“②”)端进入。
(实验Ⅱ)实验室用50g20%的浓盐酸稀释成5%的稀盐酸
(1)实验需要的玻璃仪器有胶头滴管、量筒、烧杯和______。
(2)实验的主要步骤有计算、______、稀释、转移、装瓶并贴标签。
(3)用内壁留有少量水的烧杯配制5%的稀盐酸,所配溶液溶质质量分数____(填“>”、“=”或“<”)5%。
【答案】锥形瓶 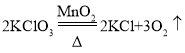 温度没有达到铁丝的着火点 C 浓硫酸 ② 玻璃棒 量取 <
温度没有达到铁丝的着火点 C 浓硫酸 ② 玻璃棒 量取 <
【解析】
[实验Ⅰ]
(1)图中b是锥形瓶;
(2)装置A固体加热型装置,且试管口没有棉花,是用氯酸钾在加热条件和二氧化锰的催化下反应生成氧气和氯化钾制取氧气,化学方程式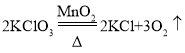 ; H中铁丝不燃烧,其原因是温度没有达到铁丝的着火点或氧气不纯;
; H中铁丝不燃烧,其原因是温度没有达到铁丝的着火点或氧气不纯;
(3)实验室制取二氧化碳气体,可选用C装置做发生装置,利用多孔隔板和长颈漏斗的组合,随时控制反应的发生与停止;
(4)要收集一瓶干燥的氢气,则应在装置D中盛放具有吸水性的浓硫酸,由于氢气密度比空气小,气体应从E装置②端进入;
[实验Ⅱ]
(1)用一定浓度的浓溶液配制稀溶液,需要经过计算、量取、稀释、转移、装瓶并贴标签,需要的玻璃仪器有胶头滴管、量筒、烧杯和玻璃棒;
(2)由上分析可知,实验的主要步骤有计算、量取、稀释、转移、装瓶并贴标签;
(3)用内壁留有少量水的烧杯配制5%的稀盐酸,导致水偏多,导致所配溶液溶质质量分<5%。

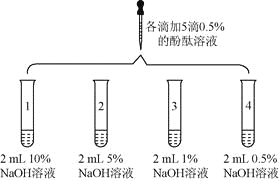
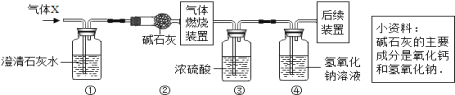
【题目】(6分)众所周知,酚酞溶液遇![]() 溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
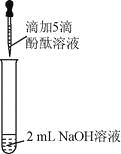
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与![]() 溶液和空气中的
溶液和空气中的![]() 反应有关。
反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
实验 | 实验操作 | 实验现象 | |
1 | 向盛有2 mL | 溶液变红 | |
2 |
| 1号试管 | |
3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度] |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
| 无浑浊物 | ||
【解释与结论】
(1)![]() 与
与![]() 反应的化学方程式为 。
反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设1 (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入![]() 水, 。
水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为![]() ,建议选用NaOH溶液的浓度为 %。
,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
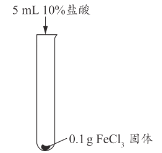
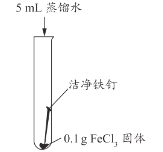
【题目】兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
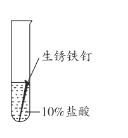
(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
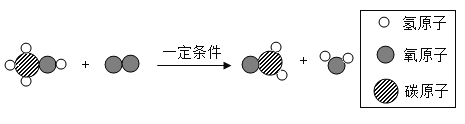
(1)用盐酸除铁锈的化学方程式为_________。
(2)实验1-1的目的是_________。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是_________。
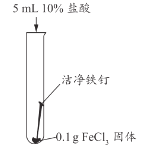
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 | 所用试剂 | 实验现象 | |
反应开始时 | 24h后 | ||
2-1 | 铁锈和2%盐酸 | 铁锈、溶液均无明显变化 | 铁锈消失,溶液变黄色 |
2-2 | 生锈铁钉和2%盐酸 | 生锈铁钉、溶液均无明显变化 | 铁锈消失,溶液变浅绿色 |
23 | 生锈铁钉和6%盐酸 | 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 | 溶液变为浅绿色 |
2-4 | 生锈铁钉和10%盐酸 | 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 | 溶液变为浅绿色 |
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与________有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为______。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间