题目内容
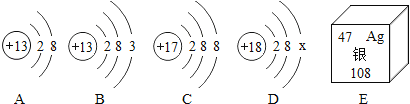
【题目】如图中A、B、C、D是四种粒子的结构示意图,E是银元素在周期表中的信息。
请回答下列问题:
(1)图中A、B、C、D四种粒子共表示_____种元素,
(2)D中x_____。
(3)E中银元素原子的质子数为_____,一个银原子质量是一个碳12原子质量的_____倍。
【答案】3 8 47 9
【解析】
A是铝离子,B是铝原子,C是氯离子,D为氩原子。
(1)依据质子数不同元素种类不同,由图示可知四种微粒中共有质子数是13、17和18的三种元素。
(2)在原子中,原子中核内质子数等于核外电子数,所以![]() 。
。
(3)根据元素周期表中各部分的意义可知,E中银元素原子的质子数为47,银的相对原子质量是108,碳的相对原子原子质量是12,一个银原子质量与一个碳12原子质量的倍数关系是 ![]() 。
。

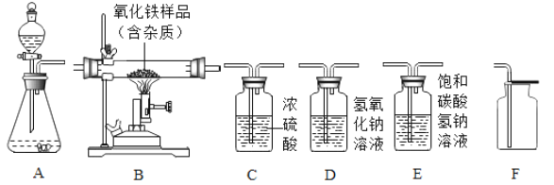
【题目】氢氧化钠是常见的碱,为探究氢氧化钠的化学性质,同学们做了如下实验:
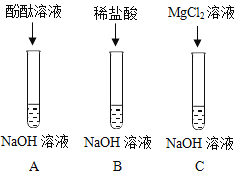
(资料)氯化镁溶液不能使酚酞溶液变红。
(1)A中溶液呈红色,说明氢氧化钠溶液显碱性,要测定它的酸碱度,可使用_____。
(2)B中没有明显的现象,该反应真的发生了吗?有同学提出,可向反应后的溶液中加入某些物质,根据相应的现象来判断,下列分析正确的有_____(填数字序号)
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
③加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
(3)C中发生反应的化学方程式是_____。该实验证明碱能与某些盐反应。
(4)实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液无色。
(提出问题)上层清液中溶质的成分是什么呢?(指示剂除外)
(作出猜想)经过讨论,大家作出两种合理的猜想:
①NaCl;②______
(实验验证)将猜想②补充完整并设计实验加以验证。
实验操作 | 实验现象 | 结论 |
取少量上层清液于试管中,滴加____溶液 | _________ | 猜想②正确 |
老师提醒同学们,实验结束后氢氧化钠溶液仍要密封保存,原因是_____(用化学方程式表示)
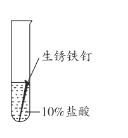
【题目】兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
(查阅资料)FeCl3的溶液呈黄色
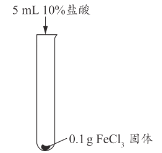
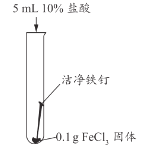
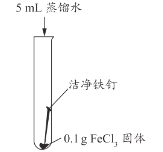
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
(1)用盐酸除铁锈的化学方程式为_________。
(2)实验1-1的目的是_________。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是_________。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 | 所用试剂 | 实验现象 | |
反应开始时 | 24h后 | ||
2-1 | 铁锈和2%盐酸 | 铁锈、溶液均无明显变化 | 铁锈消失,溶液变黄色 |
2-2 | 生锈铁钉和2%盐酸 | 生锈铁钉、溶液均无明显变化 | 铁锈消失,溶液变浅绿色 |
23 | 生锈铁钉和6%盐酸 | 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 | 溶液变为浅绿色 |
2-4 | 生锈铁钉和10%盐酸 | 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 | 溶液变为浅绿色 |
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与________有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为______。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间